tähän mennessä olemme tutkineet tapoja, joilla paria atomic orbitaalit voisi yhdistää muodostaa molekyyli orbitaalit — muodostaa sidoksia. Aivan kuten ajattelemme, että atomiorbitaalit etenevät alimmasta energiasta korkeimpaan (1s, 2s, 2p, 3s…), voimme järjestää nämä molekyyliorbitaalit niiden energian järjestyksessä.
suuressa määrin, jotta molekyyli orbitaalit energia voidaan pitää seurata, jotta atomi orbitaalit, josta ne on rakennettu., Siitä säännöstä voi joskus poiketa, mutta se on yksinkertaisin paikka aloittaa. Molekyylissä pienienergiaisimmat molekyyliorbitaalit olisivat siis ne, jotka muodostuvat alaenergiaisista atomiorbitaaleista, 1s-orbitaaleista.
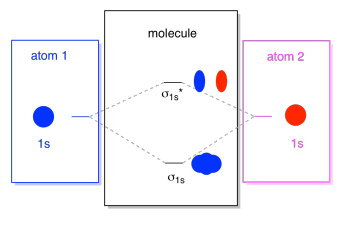
Mitä näemme täällä on molekyyli silmäkuopan vuorovaikutus kaavio. Diagrammin keskellä on vain molekyyliorbitaalienergiakaavio. Se on analoginen atomiorbitaalienergiakaavion (joka menee 1s, 2s, 2p, 3s…). Energian järjestys on toistaiseksi σ1s, σ1s*., Kaavion sivut viittaavat vain takaisin siihen, mistä ne molekyyliorbitaalit tulivat, pisteviivoilla opastamaan paikasta toiseen. Kaiken kaikkiaan kuva kertoo, että 1s silmäkuopan on yksi atomi ja 1s silmäkuopan toisaalta atom voi yhdistää kahdella eri tavalla, jotka tuottavat alemman energian, liimaus σ1s ja korkea-energia, antibonding σ1s*.
huomaa, että emme ole vielä lisänneet yhtään elektronia tuohon molekyyliorbitaalienergiakaavioon, mutta kun teemme niin, täytämme ne vain alhaalta ylöspäin, aivan kuten tekisimme atomiorbitaalienergiakaavion.,
atomiorbitaalien seuraava alin joukko on 2s-taso. Nämä pallomaiset orbitaalit yhdistyisivät hyvin paljon kuten 1s-orbitaalit, ja saisimme samanlaisen kaavion, vain hieman korkeammalla energiatasolla.
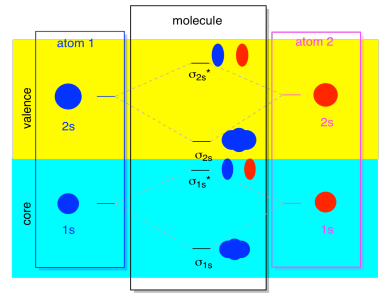
Suurimman osan ajasta, emme aio nähdä sekä σ1s ja σ2s näytetään kaaviossa. Se johtuu siitä, että jos on olemassa 2s elektroneja, niin ne 1s elektronit ovat todella ytimen elektroneja, ei valenssi. Ne hautautuvat hieman syvemmälle atomiin, eikä niillä ole kovin tärkeää roolia sitoutumisessa., Välittämättä core elektroneja on melko yleinen; jos muistatte, atomi elektroni kokoonpanoissa voisimme kirjoittaa 2s22p4 sijaan 1s22s22p4 happea; olimme välittämättä ydin. Kun piirsimme Lewisin rakenteita, annoimme hapelle kahdeksan sijasta kuusi elektronia; emme välittäneet ytimestä.
MO: n yhteydessä oletetaan, että meillä on 2S-elektroneja. Tämä tarkoittaa, että jokaisella atomilla on kaksi 1s-elektronia, yhteensä neljä. Kun nämä neljä elektronia täytetään Mo-diagrammiin alhaalta ylöspäin, ne miehittävät sekä sidoksen σ1s että antibondauksen σ1s*., Molempien käytössä olevien yhdistelmien vaikutus on kumota sidos; nämä kaksi elektroniparia pysyvät sitoutumattomina. Jotta voimme olla välittämättä niistä, emmekä oikeastaan kaipaa mitään.
2s-orbitaalit eivät ole ainoat toisessa kuoressa. On myös 2P-orbitaaleja. Muista, että on olemassa pari hyvin erilaista tapaa, joilla p-orbitaalit voivat yhdistyä toisiinsa riippuen siitä, mikä akseli ne ovat. Jos he eivät valehtele rinnakkain toisiaan-että on, jos ne ovat kohtisuorassa toisiinsa nähden, kuten px ja py-sitten he ei vuorovaikutuksessa toistensa kanssa ollenkaan., Yhden atomin pz voisi kuitenkin olla vuorovaikutuksessa toisen atomin pz: n kanssa, koska ne ovat yhdensuuntaisia keskenään.
yleensä määrittelemme z-akselin makaavan niiden kahden atomien välisellä viivalla, joita katselemme. Kaksi pz-orbitaalit makaa pitkin akselia, jokainen koru ulottuu väli atomien, ja kukin toinen koru ulottuu pois, toiseen suuntaan
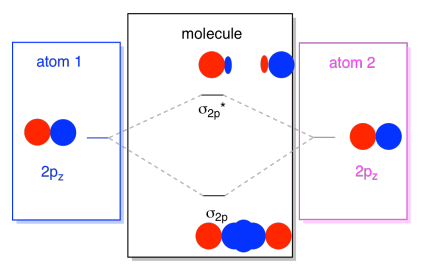
tuloksena yhdistelmiä kutsutaan σ, koska ne sijaitsevat pitkin akselin välillä atomien (joka on juuri sitä, mitä σ tarkoittaa liimaus)., On olemassa σ-yhdistelmä, jos päällekkäiset lohkot ovat faasissa keskenään ja σ* – yhdistelmä, jos nämä lohkot eivät ole faasissa keskenään. Koska nämä uudet orbitaalit syntyy atomi-2p-orbitaalit, kutsumme heitä σ2p ja σ2p*.
On myös niitä, p-orbitaalit, jotka eivät valehtele pitkin bond-akseli tai akselin välillä atomien. Px-orbitaalit ovat kohtisuorassa juuri tarkastelemaamme pz-orbitaaleihin nähden ja siten kohtisuorassa sidosten väliseen akseliin nähden. Ne ovat kuitenkin edelleen samansuuntaisia keskenään, ja ne voivat silti muodostaa yhdistelmiä., Nämä kaksi orbitaalia muodostaisivat in-faasin yhdistelmän ja out-of-faasin yhdistelmän.
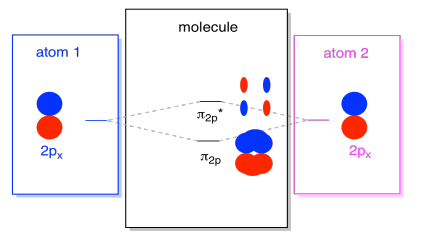
huomaa, että näiden kahden yhdistelmän energinen ero on hieman pienempi kuin σ2p-ja σ2p* – tasojen välinen ero. Ero liittyy atomiorbitaalien päällekkäisyysasteeseen. On-axis orbitaalit project voimakkaasti samaan tilaan; ne limittyvät paljon, ja ne vuorovaikutuksessa voimakkaasti. Off-akselin orbitaalit harjaavat toisiaan vasten, vuorovaikuttavat vähemmän voimakkaasti ja johtavat pienempiin energisiin muutoksiin., N2p-orbitaalin ja n2p* – orbitaalin välinen kuilu on siis paljon pienempi kuin σ2p-ja σ2p* – orbitaalien välinen.
näitä off-akselin P-orbitaaleja on todellisuudessa kaksi. Px-setin lisäksi meillä olisi py-Setti. Jos px-sarja on tasossa näytön, py-sarja on yksi kiertoradan törröttää edessä ja yksi takana. Kuitenkin yhdistelmät kahden py orbitaalit ovat täsmälleen samat kuin mitä näimme kahden px-orbitaalit. Ne vain käännetään kohtisuoraan tasolle suhteessa px yhdistelmiä.,
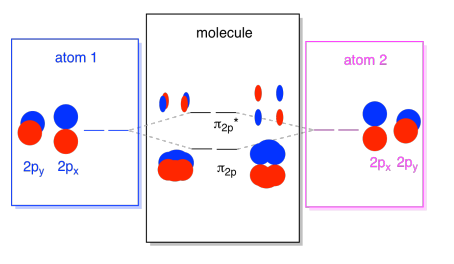
– Emme voi laittaa kaikki ne, 2p-pohjainen orbitaalit yhdessä kaaviossa. Se alkaa käydä vähän ahtaammaksi, mutta tämä kaavio on vain yhdistelmä niistä paloista, jotka olemme jo nähneet. Huomaa, että px, py, ja pz atomic orbitaalit kaikki aloittavat samaan energiaa (meillä on pinottu niitä täällä niin, että voit vielä nähdä korrelaatio atomi-ja molekyyli orbitaalit). Se tarkoittaa, että n2p & n2p* orbitaalit on ”sisäkkäisiä” välillä σ2p & σ2p* orbitaalit.,
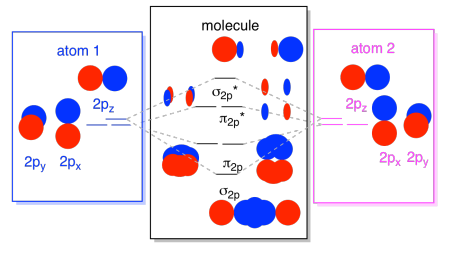
lopulta pitäen mielessä, että 2P-orbitaalit ovat energialtaan suurempia kuin 2S-orbitaalit, voimme yhdistää nämä kuvat yhdeksi diagrammiksi. Olemme jälleen nähneet nämä yksittäiset palaset ennenkin; kokoamme niitä juuri nyt.
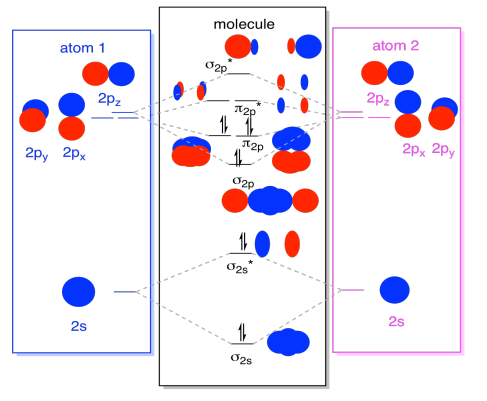
kun olemme siinä, voimme lisätä elektroneja. Miten? Se on vain valenssielektronien kokonaismäärä. Esimerkiksi olemme käyttäneet N2: ta., Jokaisella typellä on viisi valenssielektronia, yhteensä kymmenen, joten olemme juuri täyttäneet kymmenen elektronia, jotka alkavat molekyyliorbitaalin energiatasokaavion alaosasta. Jos tämä olisi toinen molekyyli, kuten F2 tai O2, meidän olisi rakentaa yleinen kaavio samalla tavalla, mutta vain käyttää eri määrä elektroneja.
yllä kuvattu kehäkuva on oikeastaan vain potentiaalinen kuva dinitypin elektronisesta rakenteesta (ja mistä tahansa muusta pääryhmästä tai p-lohkon diatomisesta)., Emme saa todellista kuvaa ditypen rakenteesta ennen kuin populoimme nämä potentiaaliset tasot elektroneilla.
- vain elektronien energiatasot vaikuttavat molekyylin energiaan (ja käyttäytymiseen).
toisin sanoen elektronien energia määrittää molekyylin käyttäytymisen. Muut energiatasot ovat vain mahdollisuuksia, jotka jäävät toteutumatta.
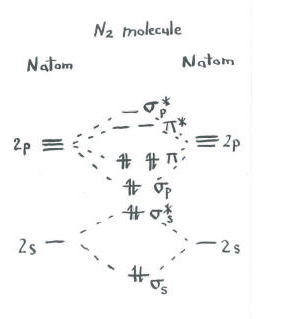
Ajattele kuva dinitrogen.
- jokaisella typellä on viisi valenssielektronia.
- elektroneja on yhteensä kymmenen.,
- kaksi kumpikin menee s-sidostasoille ja s* – antibondaustasoille. Muista, että pidimme nämä erillään P-asetuksista yksinkertaistuksena.
- kaksi kumpikin menee S p-sidokseen ja kukin p-sidostasoon.
jäljellä orbitaalit (s p* antibonding ja jokainen p * antibonding tasot) ovat tyhjillään. Nämä ovat kuvitteellisia tasoja, joilla ei ole merkitystä dityrogeenin energian määrittämisessä. Todellisessa molekyyliorbitaalilaskennassa näiden tasojen elektronit edistäisivät molekyylin kokonaisenergiaa.,
Saamme lisätietoja tästä kuvasta. Esimerkiksi, voimme nähdä bond järjestyksessä dityrogen.
- Sidosjärjestys on vain atomiparin välisten sidosten lukumäärä.
- bond-järjestys on yksi useista tekijöistä, jotka vaikuttavat kovalenttisen sidoksen vahvuuteen.
- korkeampi bond järjestys, enemmän elektronit jakautuvat atomien, ja vahvempi side.
dinitrogenissa s-sidostasot s* antibonding-tasot kumoavat toisensa. Yksi pari on pienempi energia kuin se oli atomi, mutta toinen on korkeampi., Energian nettolaskua ei ole. Nämä elektronit eivät edistä typen ja typen sidosta. Nämä ovat sitoutumattomia elektronipareja.
kuusi elektroneja s p liimaus ja p liimaus tasoa edustavat kuitenkin pienentää energiaa energian tasoilla ilmainen typpiatomeista. Nämä kolme vähäenergistä elektroniparia ilmaisevat kolme sidosta typpiatomien välillä.
muista, että olemme tehneet joitakin oikoteitä tässä kuvassa, ja todellinen molekyyliorbitaalilaskenta voisi antaa hieman erilaisia tuloksia., Siitä huolimatta se paljastaisi vielä kolmen ja kahden sitoutumattoman elektroniparin sidosjärjestyksen.
lisäksi joskus molekyyliorbitaalikuvia näytetään eri tavoin. Molekyyliorbitaalien vuorovaikutuskaavio näyttää, miten atomi-tai molekyyliorbitaalit yhdistyvät muodostaen uusia orbitaaleja. Joskus meitä ehkä kiinnostaa vain molekyyliorbitaalien energiatasot itse, eikä se, mistä ne tulivat. Molekyyliorbitaalin energiatasokaavio näyttää molekyylin energiatasot., Usein, mutta ei aina, energiatasokaaviot näytetään ilman kuvia orbitaaleista, jotta huomio kiinnittyy energiatasoihin, jotka ovat olennaisella tavalla kuvan tärkein osa. Lisäksi, koska vain miehitetyt energiatasot itse asiassa edistävät molekyylin energiaa, joskus suurenergiset, tyhjät orbitaalit jätetään pois kuvasta.

Hyvin usein tulokset molecular orbital laskelmat vahvistavat, mitä me ennustaa, Lewis rakenteita., Jos piirrät Lewis rakenne dityppen, voit myös ennustaa kolminkertainen typpi-typpi sidos. Molekyyliorbitaaliteorian tärkein etu on, että se mahdollistaa kvantitatiivisen ennustuksen energiasta, kun teemme todellisen laskelman tietokoneella. Lisäksi on tärkeää ymmärtää, että oktettisäännölle ei ole todellista syytä, ellemme harkitse kvanttimekaniikkaa. Lewisin rakenteet perustuvat empiiriseen havaintoon, jonka mukaan elektronit muodostavat pareja ja oktetteja yrittämättä selittää miksi., Molekyyliorbitaaliteoria ottaa joitakin perustavanlaatuisia suhteita fysiikasta ja soveltaa niitä erittäin monimutkaisia molekyylejä erittäin hyvällä menestyksellä. Vain tuntemalla määrä elektronit molekyyli, ja tietää suunnilleen, missä ytimet sijaitsevat rakenne, molecular orbital laskelmat antavat erittäin hyödyllisiä tietoja energiaa. Lisäksi N2: ta monimutkaisemmissa tapauksissa nämä laskelmat voivat jopa korjata ensimmäisen arvauksemme molekyyligeometriasta ja siitä, missä sidokset sijaitsevat.,
Harjoitus \(\PageIndex{2}\)
Molekyyli Silmäkuopan Kaavio on kaksiatomisen molekyylin (kaksi atomia) vaihtelee määrä elektroneja. Miten elektronit populoidaan?
vastaus • * laske molekyylin valenssielektronit. Se on jokaisen atomin valenssielektronien määrä, joka on säädetty molekyylin varaukselle. (esim. C22-on 10 valenssielektronia: 4 jokaisesta hiilestä-se on 8-ja kaksi muuta 2-varaukselle).
* täytä elektronit ensin matalaenergisille orbitaaleille.
* Parielektroneja kaikkien samalla energiatasolla olevien orbitaalien jälkeen on yksi elektroni.,
Harjoitus \(\PageIndex{3}\)
Rakentaa laadullinen molecular orbital kaavio kloori, Cl2. Vertaa bond jotta nähnyt Lewis rakenne (muista, että elektroni on antibonding orbital peruuttaa vakauttaminen, koska liimaus elektroni liimaus orbital).
Vastaus 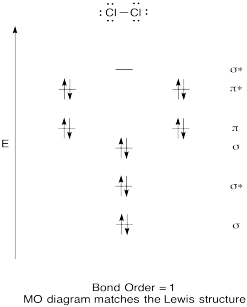
Harjoitus \(\PageIndex{4}\)
- Rakentaa laadullinen molecular orbital kaavio happi, O2.
- vertaa bond-järjestystä Lewisin rakenteessa nähtyyn.,
- miten muuten tämä hapen Mo-kuva vertautuu Lewisin rakenteeseen? Mitä nämä kaksi rakennetta kertovat elektronien pariutumisesta?
- yhdisteitä, joiden kaikki elektronit ovat pariutuneet, kutsutaan diamagneettisiksi. Niitä, joilla on parittomia elektroneja, kutsutaan paramagneettisiksi. Paramagneettisia materiaaleja vetää puoleensa magneettikenttä, mutta diamagneettisia asioita ei. Miten luulisit molekyylihapen käyttäytyvän?,
vastaus
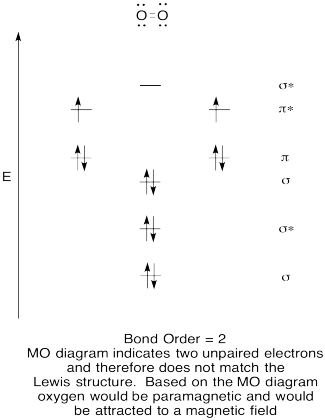
liikunta \(\PageIndex{5}\)
- muodosta peroksidianionille kvalitatiivinen molekyyliorbitaalikaavio, O22-.
- vertaa bond-järjestystä Lewisin rakenteessa nähtyyn.
- miten muuten tämä hapen Mo-kuva vertautuu Lewisin rakenteeseen? Mitä nämä kaksi rakennetta kertovat elektronien pariutumisesta?,
- Perustuu molekyyli silmäkuopan kuvia, kuinka helposti luulet dioxygen voitaisiin vähentää peroksidia (lisäämällä kaksi elektronia)?
Vastaus
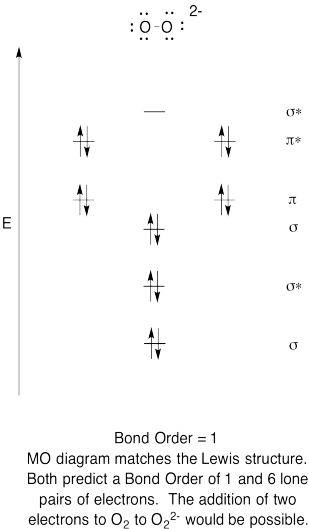
Harjoitus \(\PageIndex{6}\)
Rakentaa laadullinen molecular orbital kaavio dibooria, B2. Voisivatko booriborisidokset muodostua helposti tämän kuvan perusteella?,
Vastaus
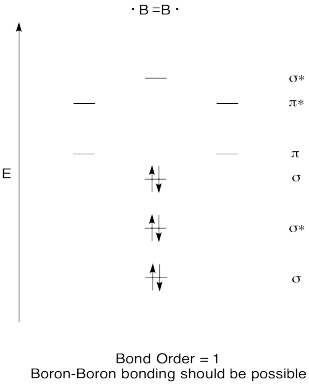
Harjoitus \(\PageIndex{7}\)
- Rakentaa laadullinen molecular orbital kaavio dicarbon, C2.
- vertaa bond-järjestystä Lewisin rakenteessa nähtyyn.
- miten muuten tämä hapen Mo-kuva vertautuu Lewisin rakenteeseen? Mitä nämä kaksi rakennetta kertovat elektronien pariutumisesta?,
Vastaus
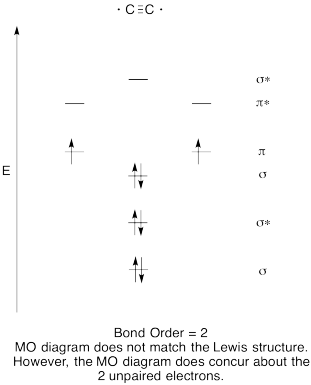
Harjoitus \(\PageIndex{8}\)
- Rakentaa laadullinen molecular orbital kaavio acetylide anioni, C22-.
- vertaa bond-järjestystä Lewisin rakenteessa nähtyyn.
- miten muuten tämä hapen Mo-kuva vertautuu Lewisin rakenteeseen? Mitä nämä kaksi rakennetta kertovat elektronien pariutumisesta?,
- Perustuu molekyyli silmäkuopan kuvia, kuinka helposti luulet dicarbon voitaisiin vähentää acetylide (lisäämällä kaksi elektronia)?
vastaus
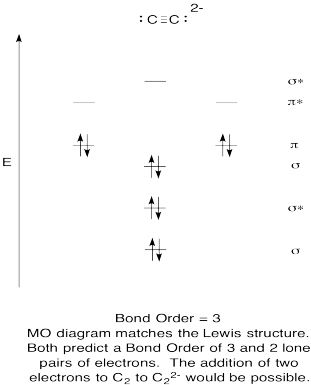
liikunta \(\PageIndex{9}\)
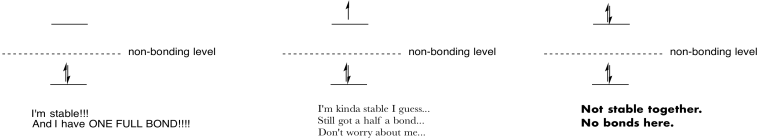
tekevät piirroksia ja muistiinpanoja, joiden avulla voidaan tiivistää antibonding-orbitaalien populaation vaikutus.
Vastaus
Nimeä
Chris P Schaller, Ph. D.,, (College of Saint Benedict / Saint John ’ s University)