Lernziele
- Um ein Verständnis der Kollisionstheorie zu erlangen.
- Um ein Verständnis der vier Hauptfaktoren zu erlangen, die die Reaktionsgeschwindigkeit beeinflussen.
Die Reaktionskinetik ist die Untersuchung der Geschwindigkeit chemischer Reaktionen, und die Reaktionsraten können über einen großen Zeitraum hinweg stark variieren. Einige Reaktionen können mit explosiv schnellen Raten ablaufen, wie z. B. die Detonation von Feuerwerkskörpern (Abbildung 17.,1 „Feuerwerk in der Nacht über dem Fluss“), während andere über viele Jahre hinweg träge auftreten können, wie das Rosten von Stacheldraht, der den Elementen ausgesetzt ist (Abbildung 17.2″Verrosteter Stacheldraht“).
Abbildung 17.1. Feuerwerk in der Nacht über Fluss
Die chemische Reaktion in Feuerwerk geschieht mit einer explosiven Geschwindigkeit.
Abbildung 17.2. Verrosteter Stacheldraht
Das Rosten von Stacheldraht tritt über viele Jahre hinweg auf.,
Kollisionstheorie
Um die Kinetik chemischer Reaktionen und die Faktoren, die die Kinetik beeinflussen, zu verstehen, sollten wir zunächst untersuchen, was während einer Reaktion auf molekularer Ebene passiert. Nach der Kollisionstheorie der Reaktivität treten Reaktionen auf, wenn reaktante Moleküle „effektiv kollidieren.“Damit eine“ effektive Kollision “ auftreten kann, müssen die Reaktantenmoleküle korrekt im Raum ausgerichtet sein, um das Brechen und Bilden von Bindungen und die Neuanordnung von Atomen zu erleichtern, die zur Bildung von Produktmolekülen führen (Abbildung 17.3 „Kollisionsvisualisierungen“).
Abbildung 17.3., Kollisionsvisualisierungen
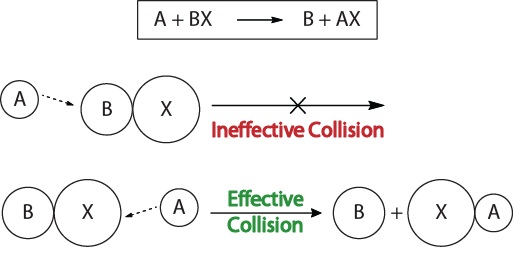
Diese Visualisierung zeigt eine ineffektive und effektive Kollision basierend auf molekularer Orientierung.
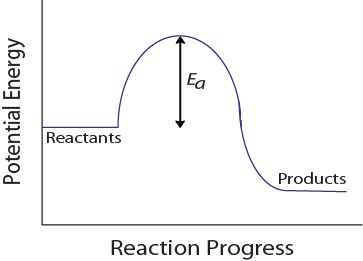
Während einer molekularen Kollision müssen Moleküle auch eine minimale kinetische Energie besitzen, damit eine effektive Kollision auftreten kann. Diese Energie variiert für jede Reaktion und wird als Aktivierungsenergie (Ea) bezeichnet (Abbildung 17.4 „Potentielle Energie und Aktivierungsenergie“)., Die Reaktionsgeschwindigkeit hängt daher von der Aktivierungsenergie ab; Eine höhere Aktivierungsenergie bedeutet, dass weniger Moleküle genügend Energie haben, um eine effektive Kollision zu erleiden.
Abbildung 17.4. Potentielle Energie und Aktivierungsenergie
Faktoren, die die Geschwindigkeit beeinflussen
Es gibt vier Hauptfaktoren, die die Reaktionsgeschwindigkeit einer chemischen Reaktion beeinflussen können:
1. Reaktantenkonzentration., Eine Erhöhung der Konzentration eines oder mehrerer Reaktanten erhöht häufig die Reaktionsgeschwindigkeit. Dies geschieht, weil eine höhere Konzentration eines Reaktanten in einem bestimmten Zeitraum zu mehr Kollisionen dieses Reaktanten führt.
2. Physikalischer Zustand der Reaktanten und der Oberfläche. Wenn reaktante Moleküle in verschiedenen Phasen existieren, wie in einem heterogenen Gemisch, wird die Reaktionsgeschwindigkeit durch die Oberfläche der Phasen begrenzt, die in Kontakt sind., Wenn beispielsweise ein fester Metallreaktant und ein Gasreaktant gemischt werden, können nur die auf der Oberfläche des Metalls vorhandenen Moleküle mit den Gasmolekülen kollidieren. Daher erhöht die Vergrößerung der Oberfläche des Metalls durch flaches Stampfen oder Schneiden in viele Stücke seine Reaktionsgeschwindigkeit.
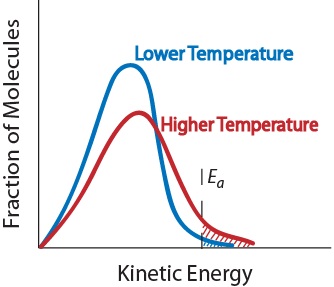
3. Temperatur. Ein Temperaturanstieg erhöht typischerweise die Reaktionsgeschwindigkeit. Ein Temperaturanstieg erhöht die durchschnittliche kinetische Energie der Reaktantenmoleküle., Daher hat ein größerer Anteil von Molekülen die minimale Energie, die für eine effektive Kollision erforderlich ist (Abbildung. 17.5 „Temperatur und Reaktionsgeschwindigkeit“).
Abbildung. 17.5 Temperatur und Reaktionsgeschwindigkeit
4. Vorhandensein eines Katalysators. Ein Katalysator ist eine Substanz, die eine Reaktion beschleunigt, indem sie daran teilnimmt, ohne verbraucht zu werden. Katalysatoren bieten einen alternativen Reaktionsweg, um Produkte zu erhalten., Sie sind entscheidend für viele biochemische Reaktionen. Sie werden im Abschnitt „Katalyse“ weiter untersucht.“
Key Takeaways
- Reaktionen treten auf, wenn zwei Reaktantenmoleküle effektiv kollidieren und jeweils minimale Energie und korrekte Ausrichtung aufweisen.
- Reaktantenkonzentration, der physikalische Zustand der Reaktanten und Oberfläche, Temperatur und das Vorhandensein eines Katalysators sind die vier Hauptfaktoren, die die Reaktionsgeschwindigkeit beeinflussen.