rønsted-Lowry Definition von Säuren und Basen
Lernziele
- Erkennen Sie eine Verbindung als Brønsted-Lowry-Säure oder Brønsted-Lowry-Base.
- Veranschaulichen Sie den Protonenübertragungsprozess, der eine Brønsted-Lowry-Säure-Base-Reaktion definiert.
Ammoniak (NH3) erhöht die Hydroxidionenkonzentration in wässriger Lösung, indem es mit Wasser reagiert, anstatt Hydroxidionen direkt freizusetzen., Tatsächlich konzentrieren sich die Arrhenius-Definitionen einer Säure und einer Base auf Wasserstoffionen und Hydroxidionen. Gibt es grundlegendere Definitionen für Säuren und Basen?
1923 schlugen der dänische Wissenschaftler Johannes Brønsted und der englische Wissenschaftler Thomas Lowry unabhängig voneinander neue Definitionen für Säuren und Basen vor. Anstatt sowohl Wasserstoff-als auch Hydroxidionen zu berücksichtigen, konzentrierten sie sich nur auf das Wasserstoffion. Eine Brønsted-Lowry acidA-Verbindung, die ein Wasserstoffion (H+) in einer Reaktion liefert; ein Protonenspender. ist eine Verbindung, die ein Wasserstoffion in einer Reaktion liefert., Eine Brønsted-Lowry-Baseeine Verbindung, die ein Wasserstoffion (H+) in einer Reaktion akzeptiert; ein Protonenakzeptor. umgekehrt ist eine Verbindung, die ein Wasserstoffion in einer Reaktion akzeptiert. Somit konzentrieren sich die Brønsted-Lowry-Definitionen einer Säure und einer Base eher auf die Bewegung von Wasserstoffionen in einer Reaktion als auf die Produktion von Wasserstoffionen und Hydroxidionen in einer wässrigen Lösung.
Lassen Sie uns die Reaktion von Ammoniak in Wasser verwenden, um die Brønsted-Lowry-Definitionen einer Säure und einer Base zu demonstrieren., Ammoniak – und Wassermoleküle sind Reaktanten, während das Ammoniumion und das Hydroxidion Produkte sind:
NH3(aq) + H2O(ℓ) → NH4+(aq) + OH−(aq)
Was in dieser Reaktion passiert ist, ist, dass das ursprüngliche Wassermolekül dem ursprünglichen Ammoniakmolekül ein Wasserstoffion gespendet hat, das wiederum das Wasserstoffion akzeptiert hat. Wir können dies wie folgt veranschaulichen:
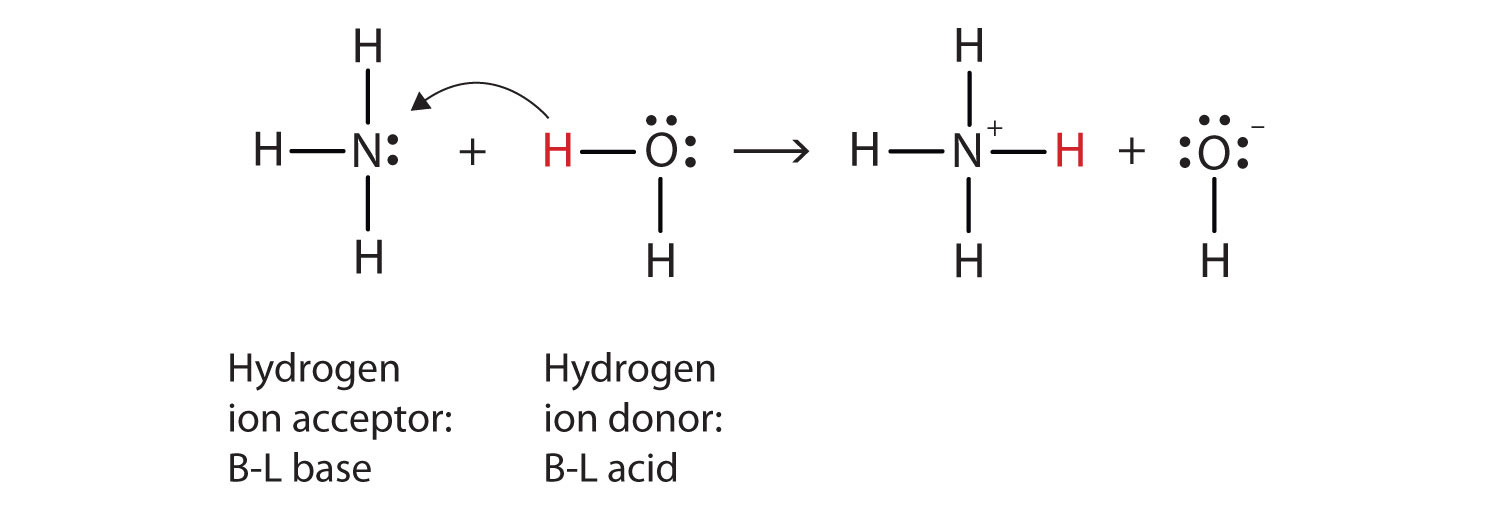
Da das Wassermolekül ein Wasserstoffion an das Ammoniak spendet, ist es die Brønsted-Lowry—Säure, während das Ammoniakmolekül—das das Wasserstoffion akzeptiert-die Brønsted-Lowry-Basis ist., Somit fungiert Ammoniak sowohl im Arrhenius-als auch im Brønsted-Lowry-Sinne als Basis.
Ist eine Arrhenius-Säure wie Salzsäure immer noch eine Säure im Brønsted-Lowry-Sinne? Ja, aber wir müssen verstehen, was wirklich passiert, wenn HCl in Wasser gelöst wird. Denken Sie daran, dass das Wasserstoffatom ein einzelnes Proton ist, das von einem einzelnen Elektron umgeben ist. Um das Wasserstoffion herzustellen, entfernen wir das Elektron und hinterlassen ein nacktes Proton. Haben wir wirklich nackte Protonen, die in wässriger Lösung herumschwimmen? Nein, wir nicht., Was wirklich passiert, ist, dass sich das H+ – Ion an H2O bindet, um H3O+ zu bilden, was als Hydroniumion bezeichnet wird. Für die meisten Zwecke repräsentieren H+ und H3O+ dieselbe Spezies, aber das Schreiben von H3O+ anstelle von H+ zeigt, dass wir verstehen, dass in Lösung keine nackten Protonen herumschwimmen. Vielmehr sind diese Protonen tatsächlich an Lösungsmittelmoleküle gebunden.
Hinweis
Ein Proton in wässriger Lösung kann von mehr als einem Wassermolekül umgeben sein, was zu Formeln wie H5O2+ oder H9O4+ anstelle von H3O+führt. Es ist jedoch einfacher, H3O+zu verwenden.,
Wie definieren wir in diesem Sinne HCl als Säure im Sinne von Brønsted-Lowry? Überlegen Sie, was passiert, wenn HCl in H2O gelöst ist:
HCl + H2O(ℓ) → H3O+(aq) + Cl−(aq)
Wir können diesen Prozess anhand von Lewis-Elektronenpunktdiagrammen darstellen:
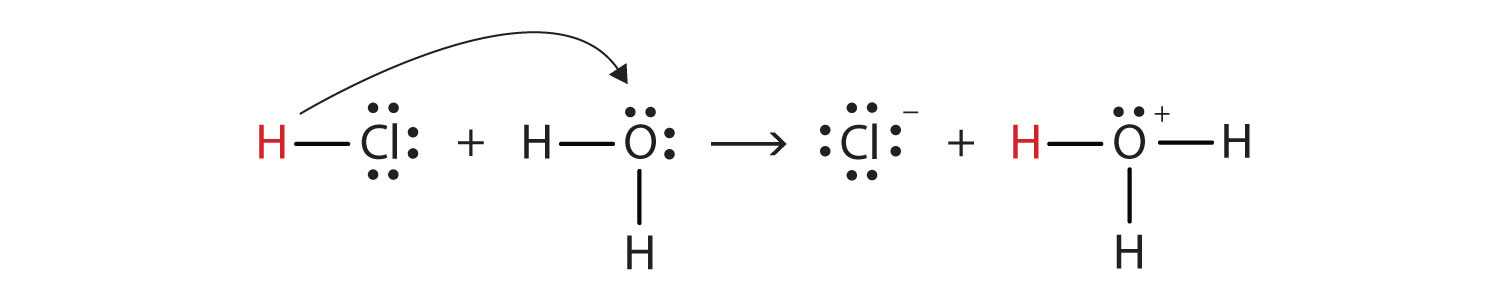
Jetzt sehen wir, dass ein Wasserstoffion vom HCl-Molekül zum H2O-Molekül übertragen wird, um Chloridionen und Hydroniumionen herzustellen. Als Wasserstoffionenspender wirkt HCl als Brønsted-Lowry-Säure; Als Wasserstoffionenakzeptor ist H2O eine Brønsted-Lowry-Base., HCl ist also nicht nur im Sinne von Arrhenius, sondern auch im Sinne von Brønsted-Lowry eine Säure. Darüber hinaus ist H2O nach den Brønsted-Lowry-Definitionen eine Base bei der Bildung von wässrigem HCl. Die Brønsted-Lowry-Definitionen einer Säure und einer Base klassifizieren also die Auflösung von HCl in Wasser als Reaktion zwischen einer Säure und einer Base—obwohl die Arrhenius-Definition H2O unter diesen Umständen nicht als Base bezeichnet hätte.
Hinweis
Alle Arrhenius-Säuren und-Basen sind Brønsted-Lowry-Säuren und-Basen. Aber nicht alle Brønsted-Lowry Säuren und Basen sind Arrhenius Säuren und Basen.,
Beispiel 3
Anilin (C6H5NH2) ist in Wasser leicht löslich. Es hat ein Stickstoffatom, das ein Wasserstoffion aus einem Wassermolekül aufnehmen kann, genau wie das Stickstoffatom in Ammoniak. Schreiben Sie die chemische Gleichung für diese Reaktion und identifizieren Sie die Brønsted-Lowry-Säure und Base.
Lösung
C6H5NH2 und H2O sind die Reaktanten. Wenn C6H5NH2 ein Proton von H2O akzeptiert, erhält es ein zusätzliches H und eine positive Ladung und hinterlässt ein OH− Ion., Die Reaktion ist wie folgt:
C6H5NH2(aq) + H2O(ℓ) → C6H5NH3+(aq) + OH−(aq)
Da C6H5NH2 nimmt ein proton, es ist die Brønsted-Lowry-base. Das H2O-Molekül, weil es ein Proton spendet, ist die Brønsted-Lowry-Säure.
Skill-Building-Übung
-
Koffein (C8H10N4O2) ist ein Stimulans gefunden in Kaffee und Tee. Wenn es in Wasser gelöst ist, kann es ein Proton aus einem Wassermolekül aufnehmen. Schreiben Sie die chemische Gleichung für diesen Prozess und identifizieren Sie die Brønsted-Lowry-Säure und Base.,
Die Brønsted-Lowry-Definitionen einer Säure und einer Base können auf chemische Reaktionen angewendet werden, die in anderen Lösungsmitteln als Wasser auftreten. Das folgende Beispiel veranschaulicht.
Beispiel 4
Natriumamid (NaNH2) löst sich in Methanol (CH3OH) auf und trennt sich in Natriumionen und Amidionen (NH2−). Die amid-Ionen reagieren mit methanol, um Ammoniak und die methoxid-ion (CH3O−). Schreiben Sie eine ausgewogene chemische Gleichung für diesen Prozess und identifizieren Sie die Brønsted-Lowry-Säure und Base.,
Lösung
Die gleichung für die reaktion ist zwischen NH2-und CH3OH zu machen NH3 und CH3O-ist wie folgt:
NH2−(solv) + CH3OH(ℓ) → NH3(solv) + CH3O – (solv)
Die label (solv) zeigt an, dass die arten sind gelöst in einige lösungsmittel, in gegensatz zu (aq), die spezifiziert eine wässrige (H2O) lösung. In dieser Reaktion sehen wir, dass das NH2-Ion ein Proton aus einem CH3OH-Molekül akzeptiert, um ein NH3-Molekül herzustellen. Somit ist NH2 als Protonenakzeptor die Brønsted-Lowry-Basis. Als Protonenspender ist CH3OH die Brønsted-Lowry-Säure.,
Skill-Building Übung
-
Pyridiniumchlorid (C5H5NHCl) löst sich in Ethanol (C2H5OH) und trennt sich in Pyridiniumionen (C5H5NH+) und Chloridionen. Das Pyridiniumion kann ein Wasserstoffion auf ein Lösungsmittelmolekül übertragen. Schreiben Sie eine ausgewogene chemische Gleichung für diesen Prozess und identifizieren Sie die Brønsted-Lowry-Säure und Base.
Für Ihre Gesundheit: Brønsted-Lowry Säure-Base-Reaktionen in Pharmazeutika
Es gibt viele interessante Anwendungen von Brønsted-Lowry Säure-Base-Reaktionen in der pharmazeutischen Industrie., Zum Beispiel müssen Medikamente oft wasserlöslich für maximale Wirksamkeit sein. Viele komplexe organische Verbindungen sind jedoch nicht löslich oder nur geringfügig in Wasser löslich. Glücklicherweise können jene Medikamente, die protonenakzeptierende Stickstoffatome enthalten (und es gibt viele davon), mit verdünnter Salzsäure reagiert werden . Die Stickstoffatome-die als Brønsted—Lowry-Basen wirken-akzeptieren die Wasserstoffionen aus der Säure, um ein Ion zu bilden, das normalerweise in Wasser viel löslicher ist., Die modifizierten Wirkstoffmoleküle können dann als Chloridsalze isoliert werden:
RN(sl aq) + H+(aq) → RNH+(aq) →Cl−(aq) RNHCl (s)
wobei RN eine organische Verbindung darstellt, die Stickstoff enthält. Das Etikett (sl aq) bedeutet „leicht wässrig“, was darauf hinweist, dass die Verbindung RN nur geringfügig löslich ist. Medikamente, die auf diese Weise modifiziert werden, werden Hydrochloridsalze genannt. Beispiele sind das starke Schmerzmittel Codein, das üblicherweise als Codeinhydrochlorid verabreicht wird. Andere Säuren als Salzsäure werden ebenfalls verwendet. Hydrobromic Säure, zum Beispiel, gibt Hydrobromide Salze., Dextromethorphan, ein Inhaltsstoff in vielen Hustenmedikamenten, wird als Dextromethorphanhydrobromid abgegeben. Die begleitende Abbildung zeigt ein anderes Medikament als Hydrochloridsalz.
Der Name dieses Arzneimittels macht deutlich, dass es als Hydrochloridsalz existiert.
© Thinkstock
Konzept-Review-Übung
-
Geben Sie die Definitionen der eine Brønsted-Lowry-Säure und einer Brønsted-Lowry-base.,
-
Eine Brønsted-Lowry-Säure ist ein Protonenspender, während eine Brønsted-Lowry-Base ein Protonenakzeptor ist.
Eine Brønsted-Lowry-Säure ist ein Protonenspender, während eine Brønsted-Lowry-Base ein Protonenakzeptor ist.
Key Takeaways
- Eine Brønsted-Lowry-Säure ist ein Protonenspender und eine Brønsted-Lowry-Base ist ein Protonenakzeptor.
- Brønsted-Lowry Säure-Base-Reaktionen sind im Wesentlichen Protonenübertragungsreaktionen.
-
Beschriften Sie jede reaktive als Brønsted-Lowry-Säure oder Brønsted-Lowry-Base.,
HCl (aq) + NH3(AQ) → NH4 + (AQ) + Cl−(AQ)
-
Label jede reaktiv als Brønsted-Lowry-Säure-oder Brønsted-Lowry-base.
H2O(ℓ)+N2H4(AQ) → N2H5 + (aq) + OH−(AQ)
-
Erklären, warum eine Brønsted-Lowry-Säure kann als ein proton donor.
-
Erklären Sie, warum eine Brønsted-Lowry-Basis als Protonenakzeptor bezeichnet werden kann.
-
Schreiben Sie die chemische Gleichung der Reaktion von Ammoniak in Wasser und beschriften Sie die Brønsted-Lowry-Säure und-Base.,
-
Schreiben Sie die chemische Gleichung der Reaktion von Methylamin (CH3NH2) in Wasser und beschriften Sie die Brønsted-Lowry-Säure und-Base.
-
Zeigen Sie, dass die Auflösung von HNO3 in Wasser tatsächlich eine Brønsted-Lowry-Säure-Base-Reaktion ist,indem Sie sie mit einer chemischen Gleichung beschreiben und die Brønsted-Lowry-Säure und-Base kennzeichnen.,
-
Identifizieren Sie die Brønsted-Lowry-Säure und-Base in der folgenden chemischen Gleichung:
C3H7NH2(aq) + H3O+(aq) → C3H7NH3+(aq) + H2O(ℓ)
-
Schreiben Sie die chemische Gleichung für die Reaktion, die auftritt, wenn sich Kokainhydrochlorid (C17H22ClNO4) proton zu einem Wassermolekül. (Wenn sich Hydrochloride in Wasser auflösen, trennen sie sich in Chloridionen und das entsprechende Kation.)
-
Wenn Codeinhydrobromid die Formel C18H22BrNO3 hat, wie lautet die Formel der Elternverbindung Codein?,
Beschriften Sie jede reaktive als Brønsted-Lowry-Säure oder Brønsted-Lowry-Base.,
HCl (aq) + NH3(AQ) → NH4 + (AQ) + Cl−(AQ)
Label jede reaktiv als Brønsted-Lowry-Säure-oder Brønsted-Lowry-base.
H2O(ℓ)+N2H4(AQ) → N2H5 + (aq) + OH−(AQ)
Erklären, warum eine Brønsted-Lowry-Säure kann als ein proton donor.
Erklären Sie, warum eine Brønsted-Lowry-Basis als Protonenakzeptor bezeichnet werden kann.
Schreiben Sie die chemische Gleichung der Reaktion von Ammoniak in Wasser und beschriften Sie die Brønsted-Lowry-Säure und-Base.,
Schreiben Sie die chemische Gleichung der Reaktion von Methylamin (CH3NH2) in Wasser und beschriften Sie die Brønsted-Lowry-Säure und-Base.
Zeigen Sie, dass die Auflösung von HNO3 in Wasser tatsächlich eine Brønsted-Lowry-Säure-Base-Reaktion ist,indem Sie sie mit einer chemischen Gleichung beschreiben und die Brønsted-Lowry-Säure und-Base kennzeichnen.,
Identifizieren Sie die Brønsted-Lowry-Säure und-Base in der folgenden chemischen Gleichung:
C3H7NH2(aq) + H3O+(aq) → C3H7NH3+(aq) + H2O(ℓ)
Schreiben Sie die chemische Gleichung für die Reaktion, die auftritt, wenn sich Kokainhydrochlorid (C17H22ClNO4) proton zu einem Wassermolekül. (Wenn sich Hydrochloride in Wasser auflösen, trennen sie sich in Chloridionen und das entsprechende Kation.)
Wenn Codeinhydrobromid die Formel C18H22BrNO3 hat, wie lautet die Formel der Elternverbindung Codein?,