Bisher haben wir untersucht, wie Paare von Atomorbitalen sich zu molekularen Orbitalen kombinieren können-um Bindungen zu bilden. So wie wir denken, dass Atomorbitale von der niedrigsten Energie zur höchsten fortschreiten (1s, 2s, 2p, 3s…), organisieren wir diese molekularen orbitalen von der Reihenfolge Ihrer Energie.
Die Reihenfolge der molekularen Orbitale in der Energie kann weitgehend als Folge der Reihenfolge der Atomorbitale betrachtet werden, aus denen sie aufgebaut sind., Es gibt einige Abweichungen von dieser Regel, manchmal, aber das ist der einfachste Ort zu starten. In einem Molekül wären die molekularen Orbitale mit der niedrigsten Energie also diejenigen, die aus den Atomorbitalen mit der niedrigsten Energie, den 1s-Orbitalen, gebildet werden.
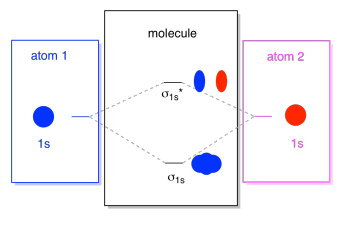
Was wir hier sehen, ist ein molekular-orbital interaction Diagramm. Die Mitte des Diagramms ist nur das molekulare Orbitalenergiediagramm. Es ist analog zum Atomorbitalenergiediagramm (das 1s, 2s, 2p, 3s geht…). Die Reihenfolge der Energie ist bisher σ1s, σ1s*., Die Seiten des Diagramms beziehen sich nur darauf, woher diese molekularen Orbitale kamen, mit gepunkteten Linien, die Sie von einem Ort zum anderen führen. Insgesamt besagt das Bild, dass das 1s-Orbital auf einem Atom und das 1s-Orbital auf dem anderen Atom auf zwei verschiedene Arten kombiniert werden können, wodurch die niedrigere Energie, die Bindung σ1s und die höhere Energie, die übereinstimmt σ1s*.
Beachten Sie, dass wir diesem molekularen Orbitalenergiediagramm noch keine Elektronen hinzugefügt haben, aber wenn wir dies tun, füllen wir sie einfach von unten nach oben aus, genau wie bei einem atomaren Orbitalenergiediagramm.,
Der nächstniedrigste Satz atomarer Orbitale ist die 2s-Ebene. Diese sphärischen Orbitale würden sich sehr ähnlich wie 1s-Orbitale kombinieren, und wir würden ein ähnliches Diagramm erhalten, nur auf einem etwas höheren Energieniveau.
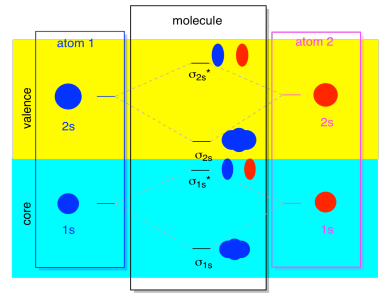
Meistens werden sowohl die σ1s als auch die σ2s im Diagramm nicht angezeigt. Das liegt daran, wenn es irgendwelche 2s Elektronen gibt, dann sind diese 1s Elektronen wirklich Kernelektronen, nicht Valenz. Sie sind etwas tiefer im Atom vergraben und spielen keine sehr wichtige Rolle bei der Bindung., Das Ignorieren der Kernelektronen ist ziemlich üblich; Wenn Sie sich erinnern, könnten wir in atomaren Elektronenkonfigurationen 2s22p4 anstelle von 1s22s22p4 für Sauerstoff schreiben; Wir haben den Kern ignoriert. Als wir Lewis-Strukturen zeichneten, gaben wir Sauerstoff sechs Elektronen statt acht; Wir ignorierten den Kern.
Angenommen, wir haben im Kontext von MO 2s Elektronen. Das muss bedeuten, dass jedes Atom zwei eigene 1s-Elektronen für insgesamt vier hat. Wenn diese vier Elektronen von unten nach oben in das MO-Diagramm gefüllt werden, nehmen sie sowohl die Bindung σ1s als auch die entsprechende σ1s*ein., Die Wirkung dieser beiden Kombinationen besetzt ist, um die Bindung aufzuheben; diese beiden Paare von Elektronen bleiben nicht-Bindung. So können wir sie ignorieren und es fehlt uns wirklich nichts.
Die 2s Orbitale sind nicht die einzigen in der zweiten Schale. Es gibt auch 2p-orbitalen. Denken Sie daran, es gibt einige sehr unterschiedliche Arten, wie sich p-Orbitale miteinander kombinieren lassen, je nachdem, auf welcher Achse sie liegen. Wenn sie nicht parallel zueinander liegen – das heißt, wenn sie senkrecht zueinander stehen, z. B. ein px und ein py -, können sie überhaupt nicht miteinander interagieren., Die pz auf einem Atom könnte jedoch mit der pz auf dem anderen Atom interagieren, da sie parallel zueinander sind.
Normalerweise definieren wir die Z-Achse so, dass sie entlang der Linie zwischen den beiden Atomen liegt, die wir betrachten. Zwei pz-Orbitale würden entlang dieser Achse liegen, jeder mit einem Lappen, der sich in den Raum zwischen den Atomen erstreckt, und jeder mit einem anderen Lappen, der sich in die andere Richtung erstreckt
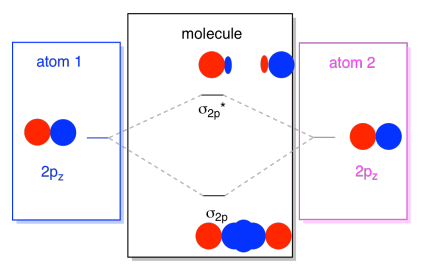
Die resultierenden Kombinationen werden σ genannt, weil sie entlang der Achse zwischen den Atomen liegen (genau das bedeutet σ in Bezug auf die Bindung)., Es gibt eine σ-Kombination, wenn die überlappenden Lappen in Phase miteinander sind, und σ* – Kombination, wenn diese Lappen nicht in Phase miteinander sind. Da diese neuen Orbitale aus den atomaren 2p-Orbitalen entstehen, nennen wir sie σ2p und σ2p*.
Es gibt auch solche p-Orbitale, die nicht entlang der Bindungsachse oder der Achse zwischen den beiden Atomen liegen. Die px-Orbitale sind senkrecht zu den gerade betrachteten pz-Orbitalen und daher senkrecht zur Achse zwischen den Bindungen. Sie sind jedoch immer noch parallel zueinander und können immer noch Kombinationen bilden., Diese beiden Orbitale würden eine In-Phase-Kombination und eine Out-of-Phase-Kombination bilden.
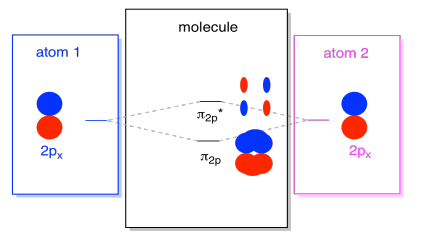
Beachten Sie, dass die energetische Trennung zwischen diesen beiden Kombinationen etwas kleiner ist als die Lücke zwischen den σ2p-und σ2p* – Ebenen. Der Unterschied hängt mit dem Grad der Überlappung zwischen den Atomorbitalen zusammen. Die Orbitale auf der Achse projizieren sich stark in denselben Raum; Sie überlappen sich stark und interagieren stark. Die außerachsigen Orbitale bürsten gegeneinander, interagieren weniger stark und führen zu kleineren energetischen Veränderungen., Der Abstand zwischen dem n2p-Orbital und dem n2p* – Orbital ist daher viel kleiner als der zwischen den σ2p-und σ2p* – Orbitalen.
Es gibt tatsächlich zwei dieser außerachsigen p-Orbitale. Zusätzlich zum px-Set hätten wir ein py-Set. Wenn sich das px-Set in der Ebene des Bildschirms befindet, hat das py-Set ein Orbital, das vorne herausragt und eines dahinter verborgen ist. Trotzdem sind die Kombinationen zwischen den beiden py-Orbitalen genau die gleichen wie zwischen den beiden px-Orbitalen. Sie werden nur in eine senkrechte Ebene in Bezug auf die px-Kombinationen gedreht.,
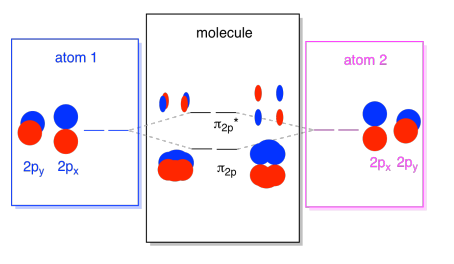
Wir können alle diese 2p-basierten Orbitale in einem Diagramm zusammenfassen. Es fängt an, ein wenig überfüllt zu werden, aber dieses Diagramm ist nur eine Kombination der Stücke, die wir bereits gesehen haben. Beachten Sie, dass die Atomorbitale px, py und pz alle mit der gleichen Energie beginnen (wir haben sie hier gestapelt, damit Sie immer noch die Korrelation zwischen den atomaren und molekularen Orbitalen sehen können). Das bedeutet, dass die n2p & n2p* orbitale werden „nested“ zwischen den σ2p & σ2p* orbitalen.,
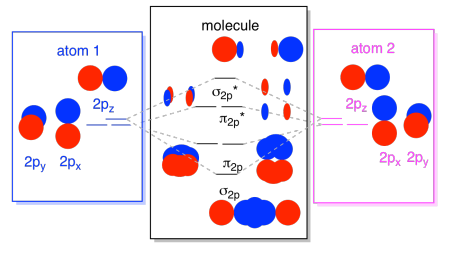
Schließlich können wir diese Bilder in einem Diagramm kombinieren, wenn man bedenkt, dass die 2p-Orbitale eine höhere Energie haben als die 2s-Orbitale. Auch hier haben wir diese Einzelstücke schon einmal gesehen; wir bauen sie gerade zusammen.
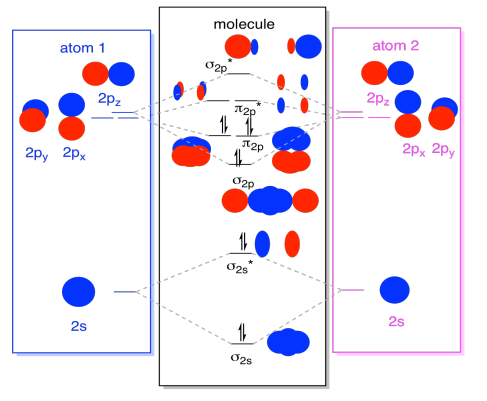
Während wir dabei sind, können wir die Elektronen hinzufügen. Wie? Es ist nur die Gesamtzahl der Valenzelektronen. Für ein Beispiel haben wir N2 verwendet., Jeder Stickstoff hat fünf Valenzelektronen für insgesamt zehn, also haben wir gerade zehn Elektronen eingefüllt, beginnend am unteren Rand des Diagramms für molekulare Orbitalenergie. Wenn dies ein anderes Molekül wie F2 oder O2 wäre, würden wir das Gesamtdiagramm auf ähnliche Weise konstruieren, aber nur eine andere Anzahl von Elektronen verwenden.
Das oben beschriebene Orbitalbild ist wirklich nur ein potenzielles Bild der elektronischen Struktur von Dinitrogen (und jeder anderen Hauptgruppe oder P-Block-Zweiatomigkeit)., Wir werden kein wirkliches Bild von Dinitrogens Struktur bekommen, bis wir diese Potentialniveaus mit Elektronen bevölkern.
- Nur die Energieniveaus mit Elektronen wirken sich auf die Energie (und das Verhalten) des Moleküls aus.
Mit anderen Worten, die Energie der Elektronen bestimmt das Verhalten des Moleküls. Die anderen Energieniveaus sind nur Möglichkeiten, die unerfüllt bleiben.
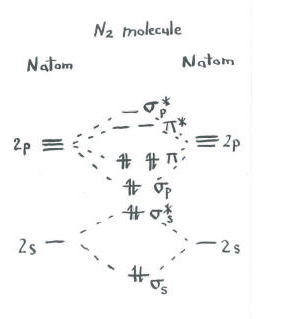
Denken Sie an das Bild von dinitrogen.
- Jeder Stickstoff hat fünf Valenzelektronen.
- Es gibt insgesamt zehn Elektronen.,
- Je zwei gehen in die s s bindung und s s* bindung ebenen. Denken Sie daran, wir haben diese als Vereinfachung vom p-Set getrennt.
- Je zwei gehen in die s p bindung und jede der p bindung ebenen.
Die verbleibenden Orbitale (s p* antibonding und jeder der p * Antibonding-Spiegel) sind unbesetzt. Dies sind imaginäre Ebenen, die keine Rolle bei der Bestimmung der Energie von Dinitrogen spielen. In einer realen molekularen Orbitalberechnung würden die Elektronen in diesen Ebenen zur Gesamtenergie des Moleküls beitragen.,
Aus diesem Bild erhalten wir weitere Informationen. Zum Beispiel können wir die Bindungsreihenfolge in Dinitrogen sehen.
- Bindungsreihenfolge ist nur die Anzahl der Bindungen zwischen einem Atompaar.
- Die Bindungsreihenfolge ist einer von mehreren Faktoren, die die Stärke der kovalenten Bindung beeinflussen.
- Je höher die Bindungsreihenfolge ist, desto mehr Elektronen werden zwischen den Atomen geteilt und desto stärker ist die Bindung.
In Dinitrogen heben sich die s s s s s* Antibonding-Spiegel gegenseitig auf. Ein Paar ist in der Energie niedriger als im Atom, aber das andere ist höher., Es gibt keine Netto-Senkung der Energie. Diese Elektronen tragen nicht zu einer Stickstoff-Stickstoff-Bindung bei. Dies sind nicht bindende Elektronenpaare.
Die sechs Elektronen in der s p-Bindung und die p-Bindung Ebenen stellen jedoch eine Abnahme der Energie aus den Energieniveaus in den freien Stickstoffatomen. Diese drei energiereichen Elektronenpaare zeigen drei Bindungen zwischen den Stickstoffatomen an.
Denken Sie daran, wir haben einige Abkürzungen in diesem Bild gemacht, und eine echte molekulare Orbitalberechnung könnte etwas andere Ergebnisse liefern., Dennoch würde es immer noch eine Bindungsreihenfolge von drei sowie zwei nicht Bindungselektronenpaaren ergeben.
Außerdem werden manchmal molekulare Orbitalbilder auf unterschiedliche Weise gezeigt. Ein molekulares Orbitalinteraktionsdiagramm zeigt, wie atomare oder molekulare Orbitale zu neuen Orbitalen zusammengefügt werden. Manchmal interessieren wir uns vielleicht nur für die molekularen orbitalen Energieniveaus selbst und nicht dafür, woher sie kommen. Ein molekulares Orbitalenergieniveau Diagramm zeigt nur die Energieniveaus im Molekül., Häufig, aber nicht immer, werden Energieniveau-Diagramme ohne Bilder der Orbitale gezeigt, um die Aufmerksamkeit auf die Energieniveaus zu lenken, die in grundlegender Weise der wichtigste Teil des Bildes sind. Da außerdem nur die besetzten Energieniveaus tatsächlich zur Energie des Moleküls beitragen, werden manchmal die energiereicheren, unbesetzten Orbitale aus dem Bild gelassen.

Sehr oft verstärken die Ergebnisse molekularer Orbitalberechnungen das, was wir aus Lewis-Strukturen vorhersagen würden., Wenn Sie eine Lewis-Struktur von Dinitrogen zeichnen, werden Sie auch eine dreifache Stickstoff-Stickstoff-Bindung vorhersagen. Der Hauptvorteil der molekularen Orbitaltheorie besteht darin, dass sie eine quantitative Vorhersage der Energie ermöglicht, wenn wir eine echte Berechnung auf einem Computer durchführen. Darüber hinaus ist es wichtig zu erkennen, dass es keinen wirklichen Grund für die Oktettregel gibt, es sei denn, wir betrachten die Quantenmechanik. Lewis-Strukturen basieren auf einer empirischen Beobachtung, dass Elektronen Paare und Oktette bilden, ohne zu erklären, warum., Die molekulare Orbitaltheorie nimmt einige grundlegende Beziehungen aus der Physik auf und wendet sie auf sehr komplizierte Moleküle mit sehr gutem Erfolg an. Nur wenn man die Anzahl der Elektronen im Molekül kennt und ungefähr weiß, wo sich die Kerne in der Struktur befinden, geben molekulare Orbitalberechnungen sehr nützliche Informationen über Energie. Darüber hinaus können diese Berechnungen in komplizierteren Fällen als N2 sogar unsere erste Vermutung über die molekulare Geometrie und den Ort der Bindungen korrigieren.,
Übung \(\paeindex{2}\)
Ein molekulares Orbitaldiagramm für ein zweiatomiges Molekül (zwei Atome) variiert in der Anzahl der Elektronen. Wie bevölkern Sie die Elektronen?
Antwort
* Zählen Sie die Valenzelektronen auf dem Molekül. Das ist die Anzahl der Valenzelektronen auf jedem Atom, angepasst an jede Ladung auf dem Molekül. (zB C22-hat 10 Valenzelektronen: 4 von jedem Kohlenstoff – das ist 8 – und zwei weitere für die 2 – Ladung).
* Füllen Elektronen in die niedrigste Energie Orbitale zuerst.
* Paar Elektronen nachdem alle Orbitale auf dem gleichen Energieniveau haben ein Elektron.,
Übung \(\paeindex{3}\)
Erstellen Sie ein qualitatives molekulares Orbitaldiagramm für Chlor, Cl2. Vergleichen Sie die Bindungsreihenfolge mit der in der Lewis-Struktur (denken Sie daran, dass ein Elektron in einem Bindungsorbital die Stabilisierung aufgrund der Bindung eines Elektrons in einem Bindungsorbital abbricht).
Antwort 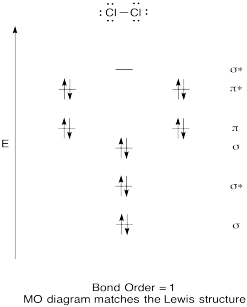
Übung \(\paeindex{4}\)
- Erstellen Sie ein qualitatives molekulares Orbitaldiagramm für Sauerstoff, O2.
- Vergleichen Sie die Bindungsreihenfolge mit der in der Lewis-Struktur.,
- Wie sonst vergleicht sich dieses MO-Bild von Sauerstoff mit der Lewis-Struktur? Was sagen Ihnen die beiden Strukturen über die Elektronenpaarung?
- Verbindungen, die alle ihre Elektronen gepaart haben, werden als diamagnetisch bezeichnet. Diejenigen mit ungepaarten Elektronen werden als paramagnetisch bezeichnet. Paramagnetische Materialien werden von einem Magnetfeld angezogen, diamagnetische Dinge jedoch nicht. Wie würden Sie erwarten, dass sich molekularer Sauerstoff verhält?,
Antwort
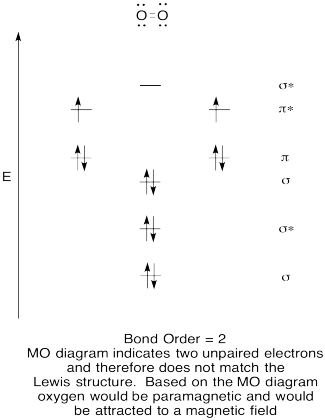
Training \(\PageIndex{5}\)
- Konstruieren eine qualitative molecular orbital-Diagramm für Peroxid anion, O22-.
- Vergleichen Sie die Bindung, um zu sehen, in der Lewis-Struktur.
- Wie sonst tut das MO-Bild von Sauerstoff im Vergleich zu den Lewis-Struktur? Was tun die beiden Strukturen, die Sie erzählen von Elektronen Paarung?,
- Wie leicht könnte Dioxygen aufgrund molekularer Orbitalbilder (durch Zugabe von zwei Elektronen) zu Peroxid reduziert werden?
Antwort
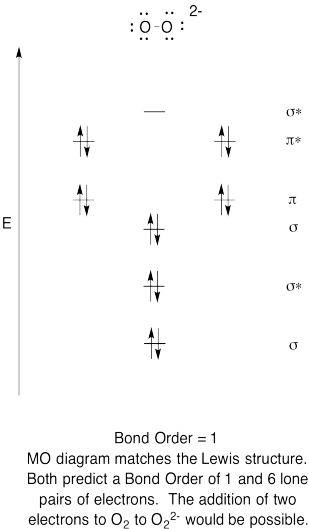
Training \(\PageIndex{6}\)
– Konstrukt eine qualitative molecular orbital-Diagramm für diboron, B2. Glauben Sie, Bor-Bor-Bindungen könnten sich leicht bilden, basierend auf diesem Bild?,
Antwort
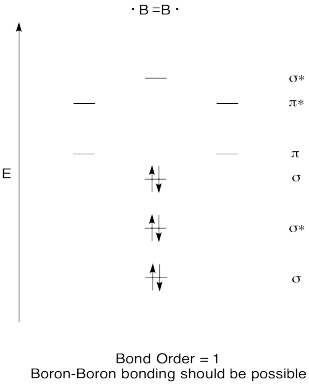
Training \(\PageIndex{7}\)
- Konstruieren eine qualitative molecular orbital-Diagramm für dicarbon, C2.
- Vergleichen Sie die Bindungsreihenfolge mit der in der Lewis-Struktur.
- Wie sonst vergleicht sich dieses MO-Bild von Sauerstoff mit der Lewis-Struktur? Was sagen Ihnen die beiden Strukturen über die Elektronenpaarung?,
Antwort
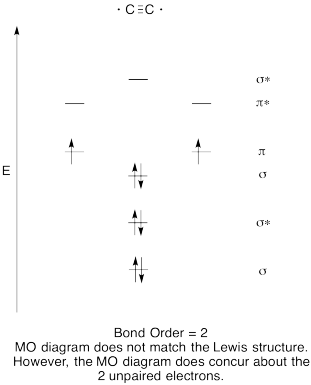
Training \(\PageIndex{8}\)
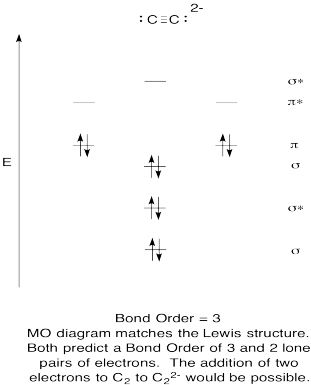
- Konstruieren eine qualitative molecular orbital-Diagramm für acetylide anion, C22-.
- Vergleichen Sie die Bindungsreihenfolge mit der in der Lewis-Struktur.
- Wie sonst vergleicht sich dieses MO-Bild von Sauerstoff mit der Lewis-Struktur? Was sagen Ihnen die beiden Strukturen über die Elektronenpaarung?,
- Wie leicht könnte Dicarbon basierend auf molekularen Orbitalbildern (durch Zugabe von zwei Elektronen) zu Acetylid reduziert werden?
Answer
Exercise \(\paeindex{9}\)
Machen Sie Zeichnungen und Notizen, um den Effekt des Auffüllens der entsprechenden Orbitale zusammenzufassen.
Answer
Attribution
Chris P Schaller, Ph. D.,, (College of Saint Benedict / Saint John ‚ s University)