Richard Baxter och Jim Britton
hur korroderar stål i vatten?
för att förstå katodskydd måste du först förstå hur korrosion orsakas. För att korrosion ska uppstå måste tre saker vara närvarande:
1. Två olika metaller
2. En elektrolyt (vatten med någon typ av salt eller salter upplöst i det)
3., En metall (ledande) väg mellan de olika metallerna
de två olika metallerna kan vara helt olika legeringar – som stål och aluminium – men är mer benägna att vara mikroskopiska eller makroskopiska metallurgiska skillnader på ytan av ett enda stycke stål. I det här fallet kommer vi att överväga fritt korroderande stål, vilket är ojämnt.
om ovanstående villkor finns, sker följande reaktion på de mer aktiva platserna: (två järnjoner plus fyra fria elektroner).,
2Fe => 2FE++ + 4e-
de fria elektronerna färdas genom metallbanan till de mindre aktiva platserna, där följande reaktion sker: (syregas omvandlas till syrejon – genom att kombinera med de fyra fria elektronerna-som kombinerar med vatten för att bilda hydroxyljoner).
O2 + 4e – + 2h20 => 4 OH-
rekombinationer av dessa joner på den aktiva ytan ger följande reaktion, vilket ger järnkorrosionsprodukten järnhydroxid: (järn som kombinerar med syre och vatten för att bilda järnhydroxid).,
2FE + O2 + 2H2O => 2FE (OH)2
denna reaktion beskrivs mer allmänt som ’strömflöde genom vattnet från anoden (mer aktiv plats) till katoden (mindre aktiv plats).’
Hur stoppar katodskydd korrosion?
katodskydd förhindrar korrosion genom att omvandla alla anodiska (aktiva) platser på metallytan till katodiska (passiva) platser genom att leverera elektrisk ström (eller fria elektroner) från en alternativ källa.
vanligtvis sker detta i form av galvaniska anoder, som är mer aktiva än stål., Denna praxis kallas också ett offersystem, eftersom de galvaniska anoderna offrar sig för att skydda konstruktionsstål eller rörledning från korrosion.
vid aluminiumanoder är reaktionen vid aluminiumytan: (fyra aluminiumjoner plus tolv fria elektroner)
4Al => 4AL+++ + 12 e –
och på stålytan: (syregas omvandlas till syrejoner som kombinerar med vatten för att bilda hydroxyljoner).,
3O2 + 12e – + 6H20 => 12OH-
så länge strömmen (fria elektroner) anländer till katoden (stål) snabbare än syre anländer, kommer ingen korrosion att uppstå.,
grundläggande överväganden vid utformning av offeranodsystem
den elektriska strömmen en anodurladdningar styrs av Ohms lag, vilket är:
i=e/r
i= strömflöde i ampere
e= skillnad i potential mellan anod och katod i volt
R= Total kretsmotstånd i ohm
initialt kommer strömmen att vara hög eftersom skillnaden i potential mellan anoden och anoden i katoden är hög, men eftersom den potentiella skillnaden minskar på grund av effekten av strömflödet på katoden minskar strömmen gradvis på grund av katodens polarisering., Kretsmotståndet innefattar både vattenvägen och metallbanan, som innehåller någon kabel i kretsen. Det dominerande värdet här är anodens motstånd mot havsvatten.
för de flesta applikationer är metallmotståndet så litet jämfört med vattenmotståndet att det kan ignoreras (även om detta inte är sant för slädar eller långa rörledningar skyddade från båda ändarna). I allmänhet har långa, tunna anoder lägre motstånd än korta, feta anoder. De kommer att släppa ut mer ström, men kommer inte att vara så länge.,
därför måste en katodskyddsdesigner dimensionera anoderna så att de har rätt form och yta för att ladda ut tillräckligt med ström för att skydda strukturen och tillräckligt med vikt för att hålla önskad livslängd vid urladdning av denna ström.
som en allmän tumregel:
längden på anoden bestämmer hur mycket ström anoden kan producera, och följaktligen hur många kvadratfot av stål kan skyddas. Tvärsnittet (vikt) bestämmer hur länge anoden kan upprätthålla denna skyddsnivå.,
Impressed-current catodic protection systems (ICCP anodsystem)
på grund av de höga strömmar som är involverade i många havsvatten system är det inte ovanligt att använda imponerade nuvarande system som använder anoder av en typ (ICCP-anoder) som inte lätt löses upp i metalljoner. Detta orsakar en alternativ reaktion: oxidationen av de upplösta kloridjonerna.
2CL – => Cl2 + 2E-
ström levereras av en extern LIKSTRÖMSENHET.,

Hur vet vi när vi har tillräckligt med katodskydd?
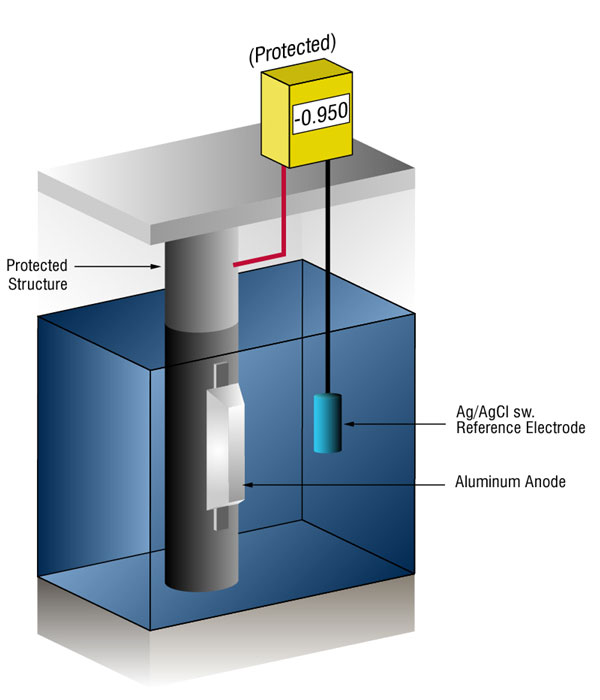
Vi kan verifiera att det finns tillräckligt med ström genom att mäta stålets potential mot en standardreferenselektrod, vanligtvis silver silver / klorid (Ag / AgCl sw.), men ibland zink (sw.).
strömflödet på någon metall kommer att flytta sin normala potential i negativ riktning. Historien har visat att om stål får tillräckligt med ström för att flytta potentialen till ( – ) 0.800 V vs., silver / silver chloride (Ag / AgCl), the corrosion is essentially stopped.
 |
 |