studien av kinetik gör det möjligt för forskare att bestämma förhållandet mellan förändringar i förhållanden och hastigheten hos en viss kemisk reaktion. En av de viktigaste faktorerna som påverkar reaktionshastigheten är reaktiviteten hos kemikalier som är involverade i den specifika reaktionen.dessutom finns det flera variabler som också kan påverka reaktionshastigheten (koncentration, temperatur, katalysator etc.).
en av dessa variabler anses vara en kollision.,
varje kemisk reaktion kräver kollisioner mellan reaktantpartiklarna (atomer och / eller molekyler). Å andra sidan främjar inte alla kollisioner reaktionen att äga rum. Istället, om de kolliderande partiklarna inte har tillräcklig kinetisk energi eller korrekt orientering i rymden, kommer reaktionen inte att uppstå.
men vad menas med ”tillräcklig energi” eller ”korrekt orientering”? För att få en bättre uppfattning om de begrepp som nämnts tidigare kommer artikeln att ge några allmänna definitioner tillsammans med motsvarande exempel och provproblem.,
vårt huvudsakliga mål är att definiera begreppet aktiveringsenergi och förklara varför några av kollisionerna inte resulterar i en reaktion.
följaktligen kommer denna artikel främst att fokusera på begreppet reaktiv kollision. Tillsammans med det kommer vi kortfattat att granska några scenarier som involverar icke-reaktiva kollisioner. Eftersom kollisioner är förknippade med två viktiga egenskaper, energi och rumslig orientering, kommer vi också att diskutera dessa termer.,
Kollisionsteori
som vi redan har nämnt ovan måste kollisioner mellan två eller flera molekyler inträffa för att en kemisk reaktion ska kunna äga rum. Men kollision räcker inte för att reaktanterna ska omvandlas till produkter. Molekyler måste ha tillräckligt med energi, och de måste kollidera med rätt rumslig orientering.
som du kanske redan vet finns det olika typer av reaktioner, inklusive syntes, sönderdelning, förskjutning och förbränning., Med tanke på att kollisionsteorin fokuserar på reaktionerna som involverar kollisioner mellan två arter, behöver du inte oroa dig mycket för sönderdelningsreaktioner eftersom i sådana fall en enda förening faller ifrån varandra, och det finns ingen anledning att överväga kollisioner eller orientering av partiklar i rymden.
vid reaktioner som involverar två arter är kollisioner mellan molekylerna avgörande för att reaktionen ska fortsätta; men endast kollisioner av molekyler med tillräcklig kinetisk energi och relevant rumslig orientering kan orsaka en reaktion., Således behövs energi för att bryta bindningarna inom reaktionsmolekylerna, medan orienteringen av molekyler i rymden spelar en viktig roll för att rada upp riktiga atomer med varandra för att reformera de trasiga bindningarna på rätt sätt.
När båda kriterierna är uppfyllda anses kollisionen vara en framgångsrik, effektiv eller reaktiv kollision.
Med tanke på vikten av de två faktorer som nämns ovan (energi och orientering) bör vi fortsätta den ytterligare förklaringen av termer och begrepp för att bättre förstå principerna för kollisionsteori.,
aktiveringsenergi
som vi redan nämnde tidigare måste partiklar kollidera med tillräckligt med energi för att en reaktion ska uppstå. Denna minsta energi som krävs för att reaktionen ska fortsätta definieras som aktiveringsenergin.,
som du kanske vet finns det två typer av reaktioner rörande energifrisättning eller absorption som är följande:
- Endotermisk reaktion – energi absorberas i en reaktion (vanligtvis i form av värme)
- exoterm reaktion – energi frigörs i en reaktion (vanligtvis i form av värme)
vid första anblicken kan det tyckas att eftersom energi frigörs i en exoterm reaktion, borde det inte finnas något behov av att mata in lite energi för energi reaktion att inträffa. Tvärtom kräver både endoterma och exoterma kemiska reaktioner energi för att komma igång.,
det verkar lite konstigt, eller hur? Varför behöver en reaktion energitillförsel om energin följaktligen frigörs?
låt oss överväga följande exempel på exoterma reaktioner som förekommer i vår vardag.

exempel #1 – bränning av ett ljus
bränningen av ett ljus frigör energi i form av värme; därför är reaktionen som uppstår under processen exoterm. Självklart måste du tända ljuset med en match eller tändare., Vad detta innebär är att du måste mata in lite energi för att ljuset ska lysa upp. Därefter har reaktionen tillräcklig energi för att gå vidare till nästa steg, och ljuset fortsätter att bränna energi.
ett ljus kommer dock aldrig att brista i flammor på egen hand, eller hur?
exempel #2 – tända en Match

ett typiskt matchhuvud består av svavel blandat med olika oxidationsmedel. För att tända tändstickan bör du gnugga matchhuvudet mot den speciella sidan av en matchbox., Under denna process sker en reaktion och frigör energi i form av ljus och värme. Således anses reaktionen vara exoterm. Även om du fortfarande behöver mata in lite energi för matchstickan för att börja brinna. Denna energi definieras via termen ” aktiveringsenergi.”På samma sätt som föregående exempel, så länge du ger tillräcklig energi för tändstickan att lysa upp, kommer det att fortsätta att bränna och släppa värme på egen hand.
Aktiveringsenergidiagram visar de energiförändringar som uppstår under en kemisk reaktion.,
för att rita aktiveringsenergidiagrammet är det viktigt att överväga två variabler:
- antal kollisioner mellan olika molekyler
- kinetisk energi hos de kolliderande molekylerna
den första variabeln är ganska lätt att förstå eftersom den har direkt betydelse – den definierar antalet kollisioner mellan partiklarna av två arter per sekund.
den andra variabeln är den kinetiska energin hos de kolliderande molekylerna, som kan definieras som energin i molekylernas rörelse.
- Endotermisk reaktion – energi absorberas., Reaktanternas energi är lägre än produkternas energi.
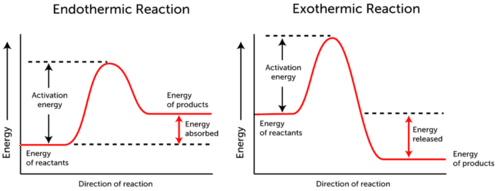
- exotermisk reaktion – energi släpps. Reaktanternas energi är mer än produkternas energi.
som du kan se i de två graferna ovan är aktiveringsenergi för både endoterma och exoterma reaktioner densamma.,
eftersom endotermisk reaktion inte kan producera så mycket energi som den behöver förbruka för att reaktionen ska uppstå absorberas energin. därför är produktens energi högre än reaktanternas energi.
tvärtom producerar exoterma reaktioner mer energi än de använder som aktiveringsenergi. Som ett resultat frigörs energin, och produkterna har lägre energi än reaktanterna.,
som en slutsats kan det konstateras att även om reaktantmolekyler snabbt kolliderar med varandra är det viktigt att molekylerna har tillräcklig energi för att reaktionen ska uppstå.
rumslig orientering
enligt kollisionsteorin är inte alla kollisioner framgångsrika, även om reaktantmolekylerna har tillräcklig aktiveringsenergi. Molekylerna måste också kollidera på rätt sätt.
så anses den andra aspekten som påverkar reaktiva kollisioner vara rumslig orientering (orientering av molekyler i rymden).,
vad menas med” korrekt ” orientering av molekyler i en reaktion?
När två molekyler kolliderar måste båda molekylerna vara placerade på det sätt som det är lätt för dem att reagera. För att fullt ut förstå konceptet är det viktigt att markera reaktionsmekanismen.
låt oss betrakta reaktionen mellan propen (eller propen) och vätebromid som ett exempel:

som du kan se ovan fortsätter reaktionen i 2 steg.,
Steg 1: dubbelbindningen är bruten
steg 2: brom är fäst
i denna reaktion spelar HBR: s och C3H6: s molekylära orientering en viktig roll eftersom en av dem var belägen på ett annat sätt, det skulle inte ha varit möjligt för H-atomen att närma sig propenmolekylen.
detta gäller för varje reaktion. Varje molekyl måste ha rätt orientering i rymden för att reaktionen ska äga rum. Korrekt orientering säkerställer att molekylerna är belägna på det sätt som det är relativt lätt för dem att kollidera och reagera.,
Vi kan dra slutsatsen att den gynnsamma orienteringen av reaktantmolekyler är lika viktig som tillräcklig aktiveringsenergi.
sammanfattning
termer och begrepp som definieras i hela artikeln sammanfattas i tabellen nedan:
| Kollisionsteori | förklarar hur partiklarna ska interagera eller med varandra för att orsaka en reaktion., Enligt Kollisionsteorin måste två kriterier uppfyllas för att en kemisk reaktion ska kunna äga rum: molekyler måste kollidera med tillräcklig aktiveringsenergi för att bryta och återskapa befintliga bindningar; molekyler måste kollidera med gynnsam rumslig orientering. |
| framgångsrik kollision (även kallad effektiv eller reaktiv kollision) | en kollision av molekyler med tillräcklig aktiveringsenergi och korrekt orientering i rymden som resulterar i en kemisk reaktion., |
| aktiveringsenergi | den minsta energi som krävs för att reaktionen ska inträffa. Inmatningen av energi behövs vid endoterma såväl som exoterma reaktioner. |
| Endotermisk reaktion | energi (värme) absorberas; reaktanternas energi är lägre än produkternas energi; kan inte producera så mycket energi som den förbrukar under reaktionen., |
| exoterm reaktion | energi (värme) frigörs; energin av reaktanter är högre än energin av produkter; kan producera mer energi än den förbrukar under reaktionen. |
| Molekylär Orientering | rumslig orientering av molekyler., |
Three different scenarios are represented in the picture attached below:
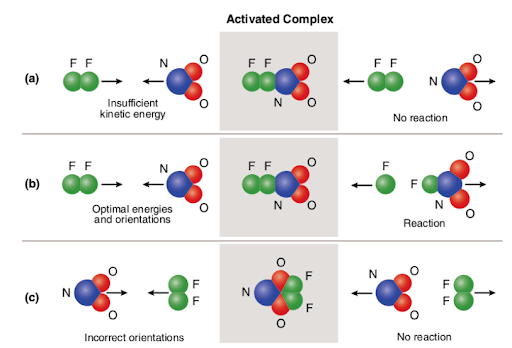
The picture summarizes the concept of collision theory utilizing two reactant molecules (fluorine (F2) and molecular nitrogen dioxide (NO2)) and three different cases to form nitrogen oxyfluoride.,
i fallet med (A) har reaktantmolekylerna korrekt rumslig orientering men har inte tillräcklig aktiveringsenergi.därför uppstår reaktionen inte på grund av att det inte finns tillräckligt med energi för att bryta bindningar. Så anses kollisionen mellan de två molekylerna vara icke-reaktiv.
När det gäller b har reaktantmolekylerna både tillräcklig aktiveringsenergi och korrekt orientering i rymden. På grund av molekylernas optimala egenskaper fortsätter reaktionen och kväveoxifluorid bildas., Så anses kollisionen mellan de två molekylerna vara reaktiv.
När det gäller (c) har reaktantmolekylerna tillräcklig aktiveringsenergi men är inte korrekt placerade i rymden.därför sker inte reaktionen eftersom det inte är möjligt för molekylerna att nå varandra på det sätt som bryter bindningar. Så, på samma sätt som det första fallet, anses kollisionen mellan de två molekylerna vara icke-reaktiv.