inlärningsmål
- för att få en förståelse för kollisionsteori.
- för att få en förståelse för de fyra huvudfaktorerna som påverkar reaktionshastigheten.
reaktionskinetik är studien av graden av kemiska reaktioner, och reaktionshastigheter kan variera kraftigt över ett stort antal tidsskalor. Vissa reaktioner kan fortsätta vid explosivt snabba hastigheter som detonation av fyrverkerier (figur 17.,1 ”fyrverkerier på natten över floden”), medan andra kan förekomma i en trög takt under många år som rost av taggtråd utsätts för elementen (figur 17.2 ”rostig taggtråd”).
figur 17.1. Fyrverkerier på natten över floden

den kemiska reaktionen i fyrverkerier sker i explosiv takt.
figur 17.2. Rostig taggtråd

rost av taggtråd sker under många år.,
Kollisionsteori
för att förstå kinetiken för kemiska reaktioner och de faktorer som påverkar kinetiken bör vi först undersöka vad som händer under en reaktion på molekylär nivå. Enligt kollisionsteorin om reaktivitet uppträder reaktioner när reaktantmolekyler ” effektivt kolliderar.”För att en” effektiv kollision ” ska uppstå måste reaktantmolekylerna orienteras i rymden korrekt för att underlätta brytning och formning av bindningar och omläggning av atomer som resulterar i bildandet av produktmolekyler (figur 17.3 ”Kollisionsvisualiseringar”).
figur 17.3., Kollisionsvisualiseringar
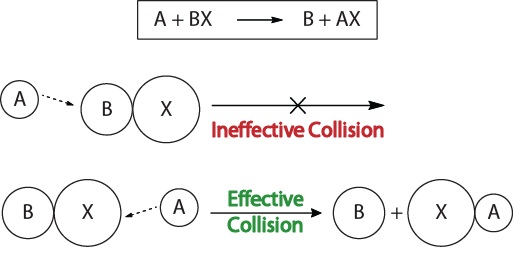
denna visualisering visar en ineffektiv och effektiv kollision baserad på molekylär orientering.
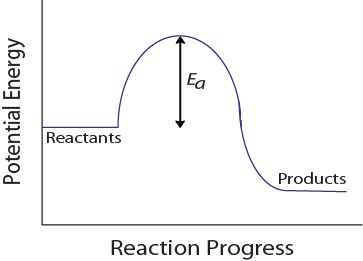
under en molekylär kollision måste molekyler också ha en minsta mängd kinetisk energi för att en effektiv kollision ska uppstå. Denna energi varierar för varje reaktion, och är känd som aktiveringsenergi (Ea) (figur 17.4 ”potentiell energi och aktiveringsenergi”)., Reaktionshastigheten beror därför på aktiveringsenergin; en högre aktiveringsenergi innebär att färre molekyler kommer att ha tillräcklig energi för att genomgå en effektiv kollision.
figur 17.4. Potentiell energi och aktiveringsenergi
faktorer som påverkar hastigheten
det finns fyra huvudfaktorer som kan påverka reaktionshastigheten för en kemisk reaktion:
1. Reaktantkoncentration., Att öka koncentrationen av ett eller flera reaktanter ökar ofta reaktionshastigheten. Detta beror på att en högre koncentration av en reaktant kommer att leda till fler kollisioner av den reaktanten under en viss tidsperiod.
2. Reaktanternas fysiska tillstånd och ytarean. Om reaktiva molekyler finns i olika faser, som i en heterogen blandning, kommer reaktionshastigheten att begränsas av ytan av faserna som är i kontakt., Till exempel, om en fast metallreaktant och gasreaktant blandas, kan endast de molekyler som finns på metallets yta kollidera med gasmolekylerna. Därför ökar metallens yta genom att dunka den platt eller skära den i många bitar sin reaktionshastighet.
3. Temperatur. En ökning av temperaturen ökar typiskt reaktionshastigheten. En ökning av temperaturen ökar den genomsnittliga kinetiska energin hos reaktantmolekylerna., Därför kommer en större andel molekyler att ha den minsta energi som krävs för en effektiv kollision(figur. 17,5 ”temperatur och reaktionshastighet”).
figur. 17,5 temperatur och reaktionshastighet
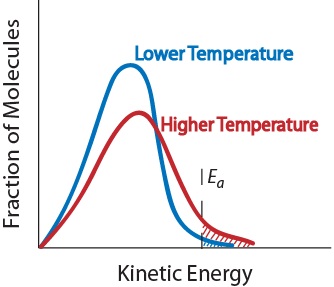
4. Närvaro av en katalysator. En katalysator är ett ämne som accelererar en reaktion genom att delta i den utan att konsumeras. Katalysatorer ger en alternativ reaktionsväg för att erhålla produkter., De är kritiska för många biokemiska reaktioner. De kommer att undersökas ytterligare i avsnittet ” katalys.”
viktiga Takeaways
- reaktioner uppstår när två reaktantmolekyler effektivt kolliderar, var och en har minimal energi och korrekt orientering.
- Reaktantkoncentration, reaktanternas fysiska tillstånd och ytarea, temperatur och närvaron av en katalysator är de fyra huvudfaktorerna som påverkar reaktionshastigheten.