10.2 Brønsted-Lowry Definition av syror och baser
inlärningsmål
- erkänner en förening som en Brønsted-Lowry syra eller en Brønsted-Lowry bas.
- illustrerar protonöverföringsprocessen som definierar en Brønsted-låg syra-basreaktion.
ammoniak (NH3) ökar hydroxidjonkoncentrationen i vattenlösning genom att reagera med vatten i stället för att frigöra hydroxidjoner direkt., Faktum är att Arrhenius-definitionerna av en syra och en bas fokuserar på vätejoner och hydroxidjoner. Finns det fler grundläggande definitioner för syror och baser?
år 1923 föreslog den danska forskaren Johannes Brønsted och den engelska forskaren Thomas Lowry självständigt nya definitioner för syror och baser. Snarare än att överväga både väte-och hydroxidjoner fokuserade de bara på vätejonen. En Brønsted-Lowry acidA förening som levererar en vätejon (H+) i en reaktion, en proton givare. är en förening som levererar en vätejon i en reaktion., En Brønsted-Lowry baseA förening som accepterar en vätejon (H+) i en reaktion, en proton acceptor. omvänt är en förening som accepterar en vätejon i en reaktion. Således fokuserar Brønsted-Lowry definitionerna av en syra och en bas på rörelsen av vätejoner i en reaktion, snarare än på produktionen av vätejoner och hydroxidjoner i en vattenhaltig lösning.
låt oss använda ammoniakreaktionen i vatten för att visa Brønsted-Lowry-definitionerna av en syra och en bas., Ammoniak och vattenmolekyler är reaktanter, medan ammoniumjonen och hydroxidjonen är produkter:
NH3(aq) + H2O(H2o) → NH4+(aq) + OH−(aq)
vad som har hänt i denna reaktion är att den ursprungliga vattenmolekylen har donerat en vätejon till den ursprungliga ammoniakmolekylen, som i sin tur har accepterat vätejonen. Vi kan illustrera detta på följande sätt:
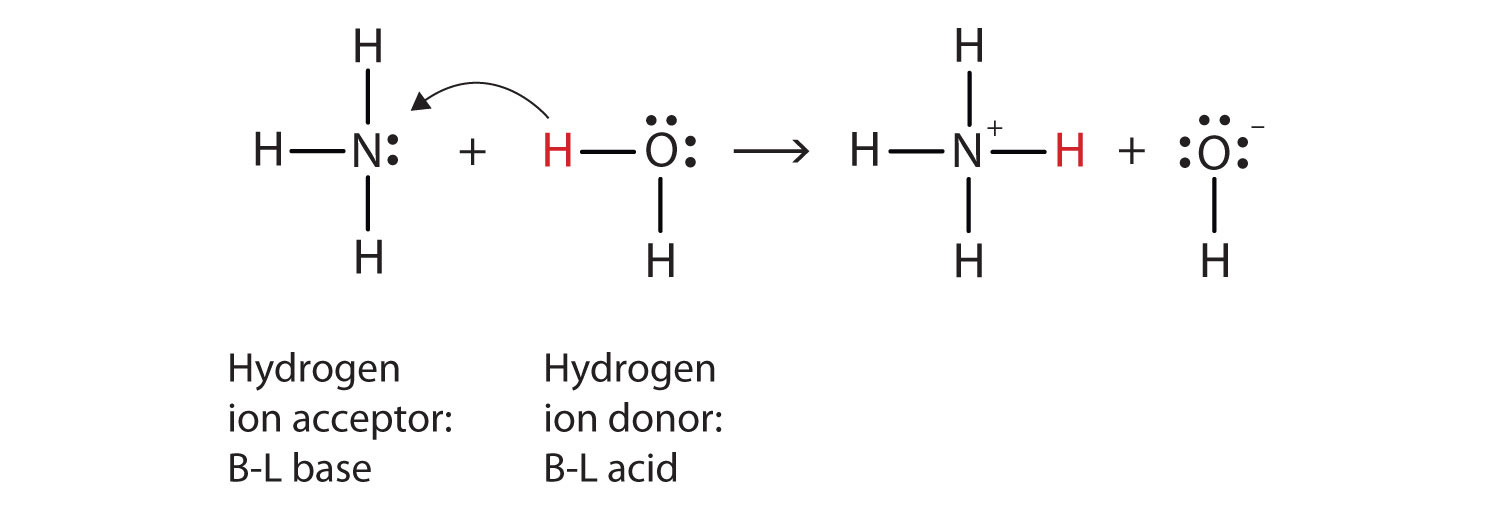
eftersom vattenmolekylen donerar en vätejon till ammoniaken är det Brønsted-Lowry syran, medan ammoniakmolekylen—som accepterar vätejonen—är Brønsted-Lowry-basen., Således fungerar ammoniak som en bas i både Arrhenius-meningen och Brønsted-Lowry-meningen.
är en Arrheniussyra som saltsyra fortfarande en syra i Brønsted-Lowry bemärkelse? Ja, men det kräver att vi förstår vad som verkligen händer när HCl löses i vatten. Minns att väteatomen är en enda proton omgiven av en enda elektron. För att göra vätejonen tar vi bort elektronen och lämnar en bar proton. Har vi verkligen nakna protoner som flyter runt i vattenlösning? Nej, det gör vi inte., Vad som verkligen händer är att h + ion fäster sig till H2O för att göra H3O+, som kallas hydroniumjon. För de flesta ändamål representerar h+ och H3O + samma art, men att skriva H3O + istället för H + visar att vi förstår att det inte finns några nakna protoner som flyter runt i lösning. Snarare är dessa protoner faktiskt kopplade till lösningsmedelsmolekyler.
notera
en proton i vattenlösning kan vara omgiven av mer än en vattenmolekyl, vilket leder till formler som h5o2+ eller H9O4+ snarare än H3O+. Det är dock enklare att använda H3O+.,
med detta i åtanke, Hur definierar vi HCl som en syra i Brønsted-Lowry bemärkelse? Tänk på vad som händer när HCl löses i H2O:
HCL + H2O () → H3O+(aq) + Cl−(aq)
Vi kan skildra denna process med hjälp av Lewis elektronpunktsdiagram:
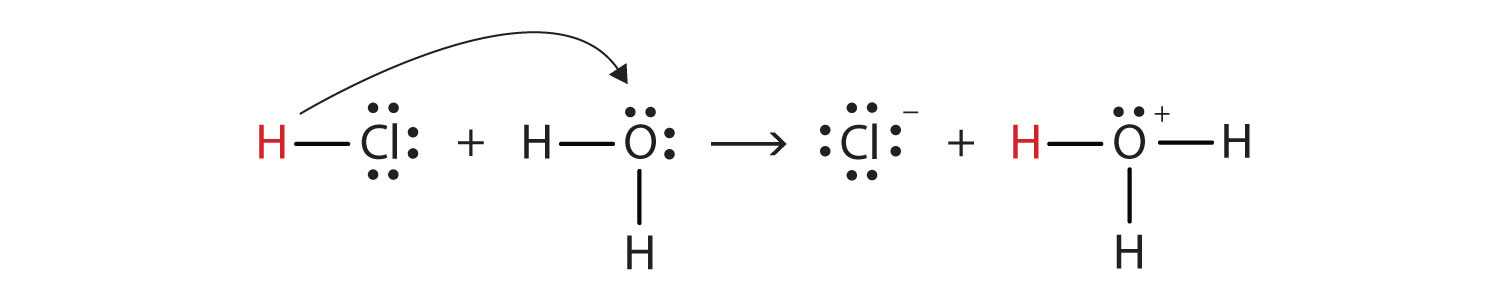
nu ser vi att en vätejon överförs från HCL-molekylen till H2o-molekylen för att göra kloridjoner och hydroniumjoner. Som vätejondonator fungerar HCl som en Brønsted-Lowry syra; som en vätejon acceptor är H2O en Brønsted-Lowry bas., Så HCl är en syra inte bara i Arrhenius mening utan också i Brønsted-Lowry bemärkelse. Dessutom är H2O enligt Brønsted-Lowry-definitionerna en bas i bildandet av vattenhaltig HCl. Så Brønsted-Lowry definitionerna av en syra och en bas klassificerar upplösningen av HCl i vatten som en reaktion mellan en syra och en bas—även om Arrhenius-definitionen inte skulle ha märkt H2O en bas i denna omständighet.
notera
alla Arrheniussyror och baser är också Brønsted-Lowry syror och baser. Men inte alla Brønsted-Lowry syror och baser är Arrhenius syror och baser.,
exempel 3
anilin (c6h5nh2) är något lösligt i vatten. Den har en kväveatom som kan acceptera en vätejon från en vattenmolekyl precis som kväveatomen i ammoniak gör. Skriv den kemiska ekvationen för denna reaktion och identifiera Brønsted-Lowry syra och bas.
lösning
C6h5nh2 och H2O är reaktanterna. När C6H5NH2 accepterar en proton från H2O, det får en extra H och en positiv laddning och lämnar en OH− ion bakom., Reaktionen är som följer:
c6h5nh2(aq) + H2o(Trip) → c6h5nh3+(aq) + OH−(aq)
eftersom c6h5nh2 accepterar en proton är det Brønsted-Lowry-basen. H2o-molekylen, eftersom den donerar en proton, är Brønsted-Lowry-syran.
färdighetsbyggande övning
-
koffein (C8h10n4o2) är ett stimulansmedel som finns i kaffe och te. När det löses i vatten kan det Acceptera en proton från en vattenmolekyl. Skriv den kemiska ekvationen för denna process och identifiera Brønsted-Lowry syra och bas.,
Brønsted-Lowry definitionerna av en syra och en bas kan tillämpas på kemiska reaktioner som uppträder i andra lösningsmedel än vatten. Följande exempel illustrerar.
exempel 4
Natriumamid (NaNH2) löses upp i metanol (CH3OH) och separeras i natriumjoner och amidjoner (NH2−). Amidjoner reagerar med metanol för att göra ammoniak och metoxidjon (CH3O−). Skriv en balanserad kemisk ekvation för denna process och identifiera Brønsted-Lowry syra och bas.,
lösning
ekvationen för reaktionen är mellan NH2− och CH3OH för att göra NH3 och CH3O-är följande:
NH2−(solv) + CH3OH () → NH3(solv) + CH3O−(solv)
etiketten (solv) indikerar att arten är upplöst i något lösningsmedel, i motsats till (aq), som anger en vattenhaltig (H2O) lösning. I denna reaktion ser vi att NH2-Jonen accepterar en proton från en CH3OH-molekyl för att göra en NH3-molekyl. Alltså, som proton acceptor, NH2− är Brønsted-Lowry bas. Som protondonator är CH3OH Brønsted-Lowry-syran.,
färdighetsbyggande övning
-
Pyridiniumklorid (C5h5nhcl) löses upp i etanol (C2H5OH) och separeras i pyridiniumjoner (C5H5NH+) och kloridjoner. Pyridiniumjon kan överföra en vätejon till en lösningsmedelsmolekyl. Skriv en balanserad kemisk ekvation för denna process och identifiera Brønsted-Lowry syra och bas.
för din hälsa: Brønsted-Lowry syra-Basreaktioner i läkemedel
det finns många intressanta tillämpningar av Brønsted-Lowry syra-basreaktioner inom läkemedelsindustrin., Till exempel behöver droger ofta vara vattenlösliga för maximal effektivitet. Men många komplexa organiska föreningar är inte lösliga eller är bara lite lösliga i vatten. Lyckligtvis kan de läkemedel som innehåller proton-Acceptera kväveatomer (och det finns många av dem) reagera med utspädd saltsyra . Kväveatomerna-som fungerar som Brønsted—Lowry baser-accepterar vätejonerna från syran för att göra en jon, som vanligtvis är mycket mer löslig i vatten., De modifierade läkemedelsmolekylerna kan sedan isoleras som kloridsalter:
RN(sl aq) + H+(aq) → RNH+(aq) →cl−(aq) RNHCl(S)
där RN representerar någon organisk förening som innehåller kväve. Etiketten (sl aq) betyder ”något vattenhaltig”, vilket indikerar att föreningen RN endast är något löslig. Läkemedel som modifieras på detta sätt kallas hydrokloridsalter. Exempel inkluderar den kraftfulla smärtstillande kodin, som vanligen administreras som kodinhydroklorid. Andra syror än saltsyra används också. Hydrobrominsyra ger till exempel hydrobromidsalter., Dextrometorfan, en ingrediens i många hostmediciner, ges som dextrometorfanhydrobromid. Den medföljande figuren visar en annan medicin som ett hydrokloridsalt.
namnet på detta läkemedel gör det klart att det finns som hydrokloridsalt.
© Thinkstock
Concept Review Exercise
-
ge definitionerna av en Brønsted-Lowry syra och en Brønsted-Lowry bas.,
svar
-
en Brønsted-Lowry syra är en protondonor, medan en Brønsted-Lowry bas är en proton acceptor.
viktiga Takeaways
- en Brønsted-Lowry syra är en protondonator, och en Brønsted-Lowry bas är en proton acceptor.
- Brønsted-Lowry syra-basreaktioner är i huvudsak protonöverföringsreaktioner.
övningar
-
märka varje reaktiv som en Brønsted-Lowry syra eller en Brønsted-Lowry bas.,
HCl (aq) + NH3(AQ) → NH4 + (AQ) + Cl−(aq)
-
märka varje reaktiv som en Brønsted-Lowry syra eller en Brønsted-Lowry bas.
H2O(n2h4 (aq) → N2H5+(aq) + OH−(AQ)
-
förklara varför en Brønsted-Lowry syra kan kallas en protondonator.
-
förklara varför en Brønsted-Lowry bas kan kallas en proton acceptor.
-
skriv den kemiska ekvationen för reaktionen av ammoniak i vatten och märk Brønsted-Lowry syra och bas.,
-
skriv den kemiska ekvationen för reaktionen av metylamin (CH3NH2) i vatten och märk Brønsted-Lowry syra och bas.
-
visar att upplösningen av HNO3 i vatten faktiskt är en Brønsted-Lowry syra-bas reaktion genom att beskriva den med en kemisk ekvation och märkning Brønsted-Lowry syra och bas.,
-
identifiera Brønsted-Lowry syra och bas i följande kemiska ekvation:
C3h7nh2(aq) + H3O+(aq) → c3h7nh3+(aq) + H2o(s)
-
skriv den kemiska ekvationen för reaktionen som uppstår när kokainhydroklorid (c17h22clno4) löses upp i vatten och vatten.donerar en proton till en vattenmolekyl. (När hydroklorider löses upp i vatten separeras de i kloridjoner och lämplig katjon.)
-
om kodeinhydrobromid har formeln c18h22brno3, vad är formeln för moderföreningen kodein?,