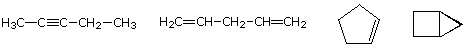introduktion
alkenes och alkynes är kolväten som respektive har kol-kol dubbelbindning och kol-kol triple bond funktionella grupper. Molekylformlerna för dessa omättade kolväten återspeglar de funktionella gruppernas multipla bindning:
alkener heter som om de var alkaner, men suffixet”- ane ”ändras till” – ene”., Om Alken innehåller endast en dubbelbindning och att dubbelbindningen är terminal (dubbelbindningen är i ena änden av molekylen eller en annan) är det inte nödvändigt att placera något nummer framför namnet.,
butan: C4H10 (CH3CH2CH2CH3)
buten: C4H8 (CH2=CHCH2CH3)
Om dubbelbindningen är inte terminal (om det är på ett kol någonstans i mitten av kedjan) då kolen ska vara numrerade på ett sådant sätt att ge den första av de två dubbel-bundna kolatomer lägsta möjliga nummer, och antalet bör föregå den ”ene” – suffix med ett streck, som visas nedan.,
korrekt: pent-2-ene (CH3CH=CHCH2CH3)
felaktig: pent-3-ene (CH3CH2CH=CHCH3)
den andra är felaktig eftersom att vända formeln horisontellt resulterar i ett lägre antal för Alken.
om det finns mer än en dubbelbindning i en alken, ska alla bindningar numreras i molekylens namn – även terminala dubbelbindningar. Siffrorna ska gå från lägsta till högsta, och separeras från varandra med ett komma. De numeriska prefixen IUPAC används för att ange antalet dubbelbindningar.,
octa-2,4-diene: CH3CH=CHCH=CHCH2CH2CH3
Deca-1,5-diene: CH2=CHCH2CH2CH=CHCH2CH2CH3
Observera att numreringen av ”2-4” över ger en molekyl med två dubbla bindningar åtskilda av bara en enda bindning. Dubbelbindningar i ett sådant tillstånd kallas ”konjugerade”, och de representerar en förbättrad stabilitet av konformation, så de är energiskt gynnade som reaktanter i många situationer och kombinationer.,
| Alkan | CnH2n+2 | detta är det maximala H/C-förhållandet för ett visst antal kolatomer. |
|---|---|---|
| Alken | CnH2n | varje dubbelbindning minskar antalet väteatomer med 2. |
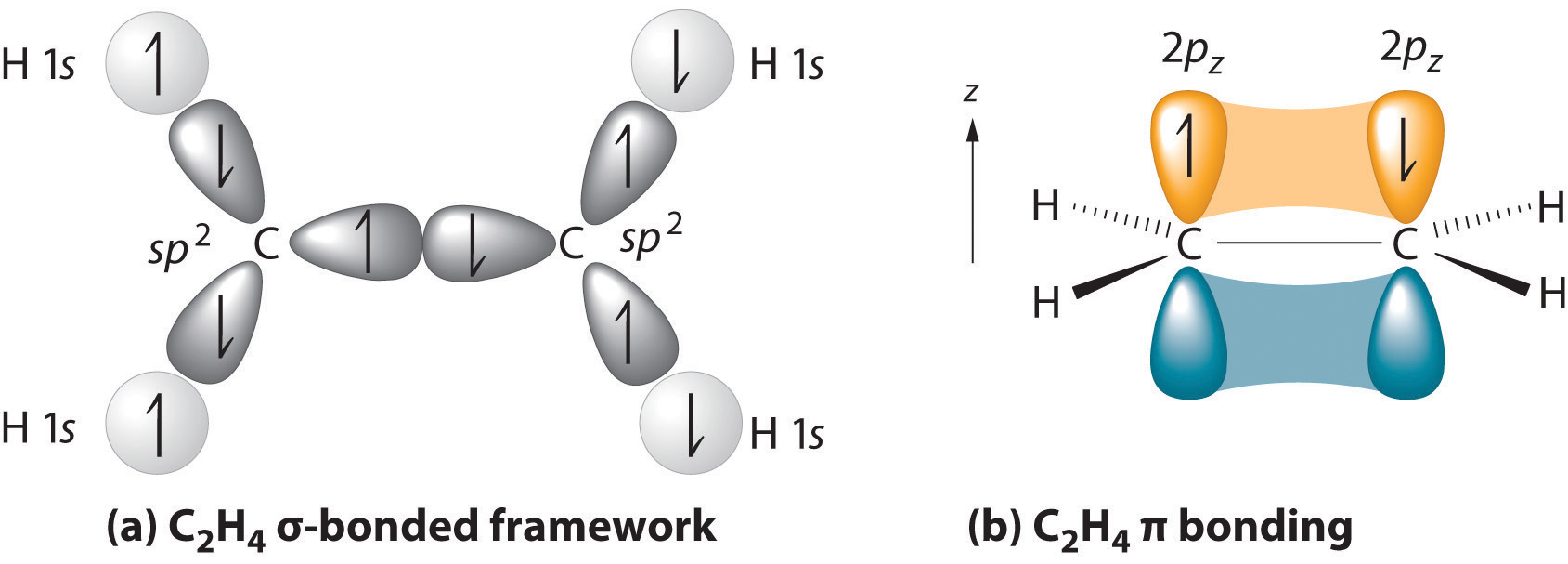
huvudstrukturen är den längsta kedjan som innehåller båda kolatomerna i dubbelbindningen., De två kolatomerna av en dubbelbindning och de fyra atomer som är fästa vid dem ligger i ett plan, med bindningsvinklar på cirka 120° består en dubbelbindning av en sigma-bindning bildad genom överlappning av SP2 hybrid orbitaler och en pi-bindning bildad genom överlappning av parallella 2 p-orbitaler
molekylformeln för ett kolväte ger information om möjliga strukturella typer som det kan representera. Tänk till exempel på föreningar med formeln C5H8., Formeln för fem-kol – alkanpentan är C5H12 så skillnaden i väteinnehåll är 4. Denna skillnad tyder på att sådana föreningar kan ha en trippelbindning, två dubbelbindningar, en ring plus en dubbelbindning eller två ringar. Några exempel visas här, och det finns minst fjorton andra!