hittills har vi tittat på hur par av atomiska orbitaler kan kombinera för att bilda molekylära orbitaler — för att bilda bindningar. Precis som vi tänker på att det finns en progression av atomiska orbitaler från lägsta energi till högsta (1s, 2s, 2p, 3s…), vi kan organisera dessa molekylära orbitaler på order av deras energi.
i stor utsträckning kan ordningen av molekylära orbitaler i energi anses följa från ordningen av de atomiska orbitaler från vilka de är konstruerade., Det finns vissa avvikelser från den regeln, ibland, men det är det enklaste stället att börja. Så, i en molekyl, skulle de lägsta energimolekylära orbitalerna vara de som bildas från de lägsta energiatomiska orbitalerna, 1s orbitalerna.
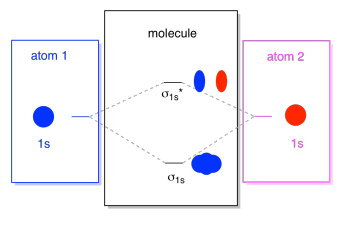
vad vi ser här är ett interaktionsschema för molekylär orbital. Mitten av diagrammet är bara det molekylära orbitala energidiagrammet. Det är analogt med det atomära orbitala energidiagrammet (som går 1s, 2s, 2p, 3s…). Energiordningen hittills är σ1s, σ1s*., Sidorna av diagrammet hänvisar bara tillbaka till var de molekylära orbitalerna kom ifrån, med prickade linjer för att styra dig från en plats till en annan. Sammantaget säger bilden att 1s orbital på en atom och 1s orbital på den andra atomen kan kombinera på två olika sätt, vilket ger lägre energi, bindning σ1s och högre energi, antibonding σ1s*.
Observera att vi inte har lagt till några elektroner till det molekylära orbitalenergidiagrammet ännu, men när vi gör det kommer vi bara att fylla dem från botten upp, precis som vi skulle ett atomärt orbitalenergidiagram.,
nästa lägsta uppsättning atomiska orbitaler är 2s-nivån. Dessa sfäriska orbitaler skulle kombinera väldigt mycket som 1s orbitaler, och vi skulle få ett liknande diagram, bara på en något högre energinivå.
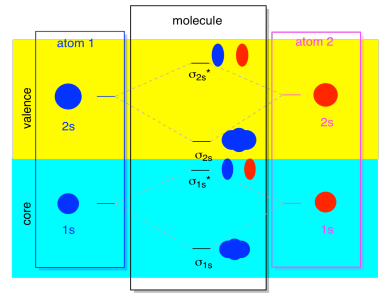
För det mesta kommer vi inte att se både σ1s och σ2s som visas i diagrammet. Det beror på att om det finns några 2s elektroner, så är dessa 1s elektroner verkligen kärnelektroner, inte valensen. De är begravda lite djupare i atomen, och de spelar inte en mycket viktig roll i bindning., Att ignorera kärnelektronerna är ganska vanligt; om du kommer ihåg, i atomelektronkonfigurationer kan vi skriva 2s22p4 istället för 1s22s22p4 för syre; vi ignorerade kärnan. När vi ritade Lewis strukturer gav vi syre sex elektroner, snarare än åtta; vi ignorerade kärnan.
i samband med MO, anta att vi har 2s elektroner. Det måste innebära att varje atom har två 1s elektroner av sig själv, för totalt fyra. När dessa fyra elektroner fylls i Mo-diagrammet nerifrån och upp, kommer de att uppta både bindningen σ1s och antibonding σ1s*., Effekten av båda dessa kombinationer som upptas är att avbryta bindningen; dessa två par elektroner förblir icke-bindning. Så vi kan ignorera dem och vi saknar ingenting.
2s orbitalerna är inte de enda i det andra skalet. Det finns också 2P orbitaler. Kom ihåg att det finns ett par mycket olika sätt på vilka orbitaler kan kombinera med varandra, beroende på vilken axel de ligger. Om de inte ligger parallellt med varandra-det vill säga om de är vinkelräta mot varandra, som en px och en py-kan de inte interagera med varandra alls., Pz på en atom kan interagera med pz på den andra atomen, eftersom de är parallella med varandra.
vanligtvis definierar vi Z-axeln som att ligga längs linjen mellan de två atomer vi tittar på. Två PZ-orbitaler skulle ligga längs den axeln, var och en med en lob som sträcker sig in i utrymmet mellan atomerna och var och en med en annan lob som sträcker sig bort, i andra riktningen
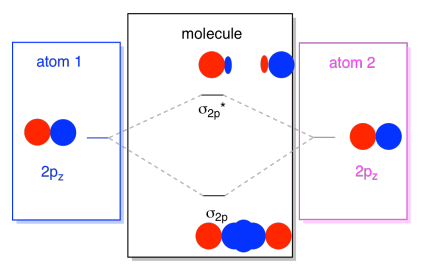
de resulterande kombinationerna kallas σ eftersom de ligger längs axeln mellan atomerna (det är exakt vad σ betyder när det gäller bindning)., Det finns en σ-kombination, om de överlappande loberna är i fas med varandra och σ* – kombinationen, om dessa lober är ur fas med varandra. Eftersom dessa nya orbitaler uppstår från atomära 2P-orbitalerna kallar vi dem σ2p och σ2p*.
det finns också de p-orbitaler som inte ligger längs bondaxeln eller axeln mellan de två atomerna. Px-orbitalerna är vinkelräta mot de PZ-orbitaler som vi bara tittade på, och därför vinkelräta mot axeln mellan bindningarna. Men de är fortfarande parallella med varandra, och de kan fortfarande bilda kombinationer., Dessa två orbitaler skulle ingå i kombinationen, och en out-of-fas kombination.
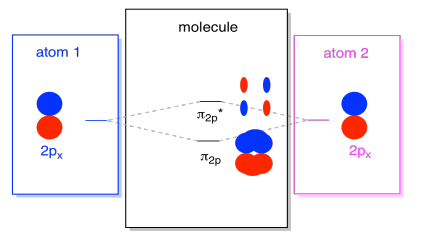
Observera att den energiska separationen mellan dessa två kombinationer är lite mindre att klyftan mellan σ2p-och σ2p* – nivåerna. Skillnaden är relaterad till graden av överlappning mellan atombanorna. Den on-axis orbitals projektet starkt i samma utrymme; de överlappar mycket, och de interagerar starkt. De Off-axliga orbitalerna borstar mot varandra, interagerar mindre starkt och resulterar i mindre energiska förändringar., Klyftan mellan N2P-orbitalen och N2P* – orbitalen är därför mycket mindre än den mellan σ2p och σ2p* – orbitalerna.
det finns faktiskt två av dessa off-axis p orbitaler. Förutom px-uppsättningen skulle vi ha en py-uppsättning. Om px-uppsättningen är i skärmens plan har Py-uppsättningen en orbital som sticker ut framför och en dold bakom. Ändå är kombinationerna mellan de två Py-orbitalerna exakt desamma som vad vi såg mellan de två px-orbitalerna. De roteras bara i ett vinkelrätt plan med avseende på px-kombinationerna.,
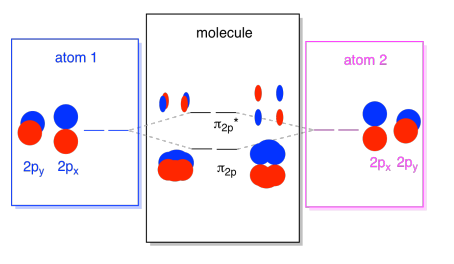
Vi kan sätta alla dessa 2P-baserade orbitaler tillsammans i ett diagram. Det börjar bli lite mer trångt, men det här diagrammet är bara en kombination av de bitar vi redan har sett. Observera att px, py och Pz atomiska orbitaler alla börjar på samma energi (vi har staplat dem här så att du fortfarande kan se sambandet mellan atomära och molekylära orbitaler). Det betyder att N2P& N2P* orbitaler kommer att ”kapslas” mellan σ2p& σ2p* orbitaler.,
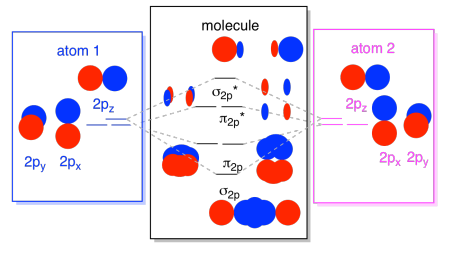
slutligen, med tanke på att 2P-orbitalerna är högre i energi än 2s-orbitalerna, kan vi kombinera dessa bilder i ett diagram. Återigen har vi sett dessa enskilda bitar tidigare; vi monterar dem bara nu.
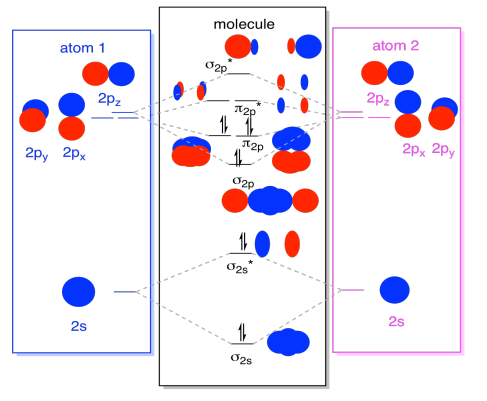
medan vi är på det, kan vi lägga till i elektronerna. Hur? Det är bara det totala antalet valenselektroner. Till exempel har vi använt N2., Varje kväve har fem valenselektroner, för totalt tio, så vi har just fyllt i tio elektroner, med början längst ner i molekylär orbital energinivådiagrammet. Om detta var en annan molekyl, som F2 eller O2, skulle vi konstruera det övergripande diagrammet på ett liknande sätt, men bara använda ett annat antal elektroner.
den orbitalbild vi har beskrivit ovan är egentligen bara en potentiell bild av dinitrogens elektroniska struktur (och någon annan huvudgrupp eller p-blockdiatomisk)., Vi kommer inte att få en riktig bild av dinitrogens struktur förrän vi fyller dessa potentiella nivåer med elektroner.
- endast energinivåerna med elektroner har en effekt på molekylens energi (och beteende).
med andra ord bestämmer elektronernas energi molekylens beteende. De andra energinivåerna är bara möjligheter som förblir ouppfyllda.
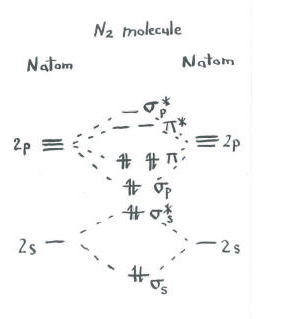
Tänk på bilden av dinitrogen.
- varje kväve har fem valenselektroner.
- Det finns totalt tio elektroner.,
- två vardera går in i S S bindning och S S* antibonding nivåer. Kom ihåg att vi höll dessa åtskilda från p-uppsättningen som en förenkling.
- två går in i S p-bindningen och var och en av p-bindningsnivåerna.
de återstående orbitalerna (S P* antibonding och var och en av p * antibonding-nivåerna) är obesatta. Dessa är imaginära nivåer som inte spelar en roll för att bestämma dinitrogens energi. I en verklig molekylär orbitalberäkning skulle elektronerna i dessa nivåer bidra till molekylens totala energi.,
vi får ytterligare information från den här bilden. Till exempel kan vi se obligationsordningen i dinitrogen.
- Bond order är bara antalet bindningar mellan ett par atomer.
- obligationsordningen är en av flera faktorer som påverkar styrkan hos den kovalenta bindningen.
- ju högre bindningsordningen desto fler elektroner delas mellan atomerna och desto starkare bindningen.
i dinitrogen avbryter s s bindning s* antibonding nivåer varandra. Ett par är lägre i energi än det var i atomen, men den andra är högre., Det finns ingen nettosänkning av energi. Dessa elektroner bidrar inte till en kväve-kvävebindning. Dessa är icke-bindande elektronpar.
de sex elektronerna i S p-bindningen och p-bindningsnivåerna representerar emellertid en minskning av energi från energinivåerna i de fria kväveatomerna. Dessa tre, lågenergipar av elektroner indikerar tre bindningar mellan kväveatomerna.
Kom ihåg att vi har gjort några genvägar i den här bilden, och en verklig molekylär orbitalberäkning kan ge lite olika resultat., Ändå skulle det fortfarande avslöja en bindningsordning på tre såväl som två icke-bindningselektronpar.
dessutom visas ibland molekylära orbitalbilder på olika sätt. Ett molekylärt orbital interaktionsschema visar hur atomära eller molekylära orbitaler kombineras för att skapa nya orbitaler. Ibland kan vi bara vara intresserade av molekylära orbital energinivåer själva, och inte var de kom ifrån. Ett molekylärt orbitalenerginivådiagram visar bara energinivåerna i molekylen., Ofta, men inte alltid, visas energinivådiagram utan några bilder av orbitalerna, för att fokusera uppmärksamhet på energinivåerna, som på ett grundläggande sätt är den viktigaste delen av bilden. Dessutom, eftersom endast de ockuperade energinivåerna faktiskt bidrar till molekylens energi, lämnas ibland högre energi, obesatta orbitaler ut ur bilden.

ofta förstärker resultaten av molekylära orbitalberäkningar vad vi skulle förutsäga från Lewis strukturer., Om du ritar en Lewis struktur av dinitrogen, kommer du också att förutsäga en trippel kväve-kvävebindning. Den främsta fördelen med molekylär orbitalteori är att den möjliggör kvantitativ förutsägelse av energi när vi gör en riktig beräkning på en dator. Dessutom är det viktigt att inse att det inte finns någon verklig anledning till oktettregeln om vi inte överväger kvantmekanik. Lewis strukturer bygger på en empirisk observation att elektroner bildar par och oktetter, utan att försöka förklara varför., Molekylär orbital teori tar några grundläggande relationer från fysik och tillämpar dem på mycket komplicerade molekyler med mycket god framgång. Bara genom att veta antalet elektroner i molekylen, och genom att veta ungefär var kärnorna finns i strukturen, ger molekylära orbitalberäkningar mycket användbar information om energi. Dessutom, i mer komplicerade fall än N2, kan dessa beräkningar till och med korrigera vår första gissning om molekylär geometri och var bindningarna finns.,
övning \(\Pageindex{2}\)
ett molekylärt Orbitaldiagram för en diatomisk molekyl (två atomer) varierar i antalet elektroner. Hur fyller du elektronerna?
svar • * räkna valenselektronerna på molekylen. Det är antalet valenselektroner på varje atom, justerat för någon laddning på molekylen. (t. ex. C22-har 10 valenselektroner: 4 från varje kol – det är 8 – och ytterligare två för 2-laddningen).
• fyll elektroner i de lägsta energi orbitalerna först.
* par elektroner efter alla orbitaler på samma energinivå har en elektron.,
övning \(\PageIndex{3}\)
konstruera ett kvalitativt molekylärt orbitaldiagram för klor, Cl2. Jämför bindningsordningen till den som ses i Lewis-strukturen (kom ihåg att en elektron i en antibonding orbital avbryter stabiliseringen på grund av bindning av en elektron i en bindningsbana).
svar 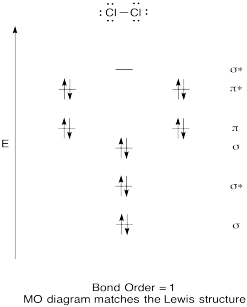
övning \(\Pageindex{4}\)
- konstruera ett kvalitativt molekylärt orbitaldiagram för syre, O2.
- jämför bondordern till den som ses i Lewis-strukturen.,
- hur jämför den här mo-bilden av syre med Lewis-strukturen? Vad berättar de två strukturerna om elektronparning?
- föreningar som har alla sina elektroner Parade kallas diamagnetiska. De med oparade elektroner kallas paramagnetiska. Paramagnetiska material lockas av ett magnetfält, men diamagnetiska saker är inte. Hur skulle du förvänta dig molekylärt syre att bete sig?,
svar
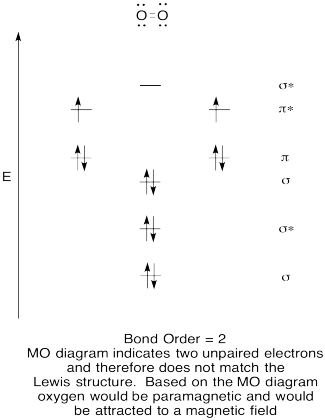
övning \(\Pageindex{5}\)
- konstruera ett kvalitativt molekylärt orbitaldiagram för peroxidanjon, O22-.
- jämför bondordern till den som ses i Lewis-strukturen.
- hur jämför den här mo-bilden av syre med Lewis-strukturen? Vad berättar de två strukturerna om elektronparning?,
- baserat på molekylära orbitalbilder, hur lätt tror du att dioxygen kan reduceras till peroxid (genom tillsats av två elektroner)?
svar
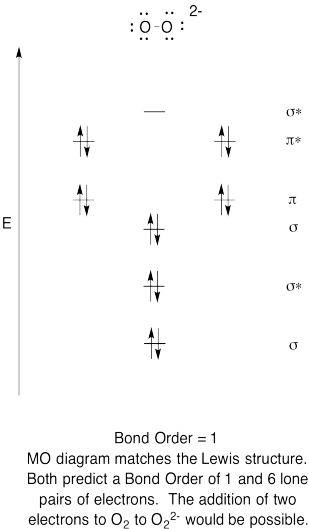
övning \(\PageIndex{6}\)
konstruera ett kvalitativt molekylärt orbitaldiagram för diboron, B2. Tror du att Boron-bor-obligationer kan bildas enkelt, baserat på den här bilden?,
svara
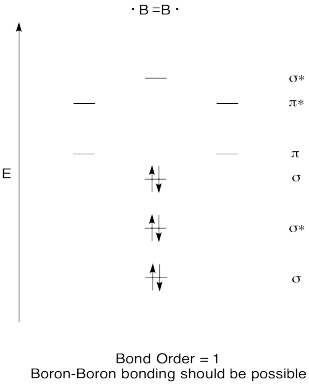
Motion \(\Pageindex{7}\)
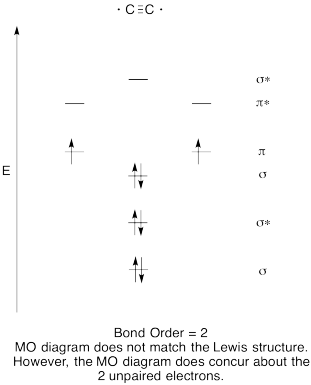
- konstruera ett kvalitativt molekylärt orbitaldiagram för dikarbon, C2.
- jämför bondordern till den som ses i Lewis-strukturen.
- hur jämför den här mo-bilden av syre med Lewis-strukturen? Vad berättar de två strukturerna om elektronparning?,
svar
övning \(\PageIndex{8}\)
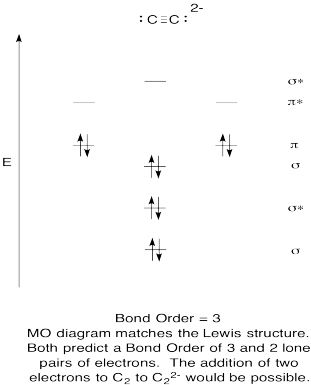
- konstruera ett kvalitativt molekylärt orbitaldiagram för acetylidanjon, C22 -. – herr talman!
- jämför bondordern till den som ses i Lewis-strukturen.
- hur jämför den här mo-bilden av syre med Lewis-strukturen? Vad berättar de två strukturerna om elektronparning?,
- baserat på molekylära orbitalbilder, hur lätt tror du att dicarbon kan reduceras till acetylid (genom tillsats av två elektroner)?
svar
övning \(\PageIndex{9}\)
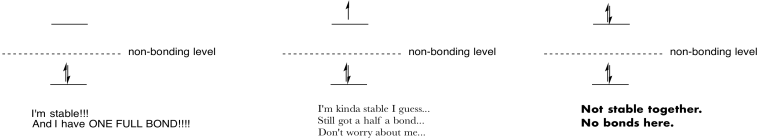
gör ritningar och anteckningar för att sammanfatta effekten av att fylla antibonding orbitaler.
svara
erkännande
Chris p Schaller, Ph. D.,, (College of Saint Benedict / Saint John ’ s University)