studiul cineticii permite oamenilor de știință să determine relația dintre schimbările condițiilor și viteza unei anumite reacții chimice. Unul dintre cei mai importanți factori care afectează viteza unei reacții este reactivitatea substanțelor chimice implicate în acea reacție specifică; în plus, există mai multe variabile care pot afecta și viteza unei reacții (concentrație, temperatură, catalizator etc.).). una dintre aceste variabile este considerată a fi o coliziune., fiecare reacție chimică necesită coliziuni între particulele reactante (atomi și/sau molecule). Pe de altă parte, nu toate coliziunile promovează reacția care va avea loc. În schimb, dacă particulele care se ciocnesc nu au suficientă energie cinetică sau orientare adecvată în spațiu, reacția nu va avea loc. dar ce se înțelege prin” energie suficientă „sau”orientare adecvată”? Pentru a obține o idee mai bună despre conceptele menționate anterior, articolul va oferi câteva definiții generale însoțite de exemple corespunzătoare și probleme de probă., scopul nostru principal este de a defini conceptul de energie de activare și de a explica de ce unele dintre coliziuni nu au ca rezultat o reacție. în consecință, acest articol se va concentra în primul rând pe conceptul de coliziune reactivă. În același timp, vom analiza pe scurt câteva scenarii care implică coliziuni nereactive. Deoarece coliziunile sunt asociate cu două caracteristici majore, energia și orientarea spațială, vom discuta și acești Termeni., așa cum am menționat deja mai sus, trebuie să apară coliziuni între două sau mai multe molecule pentru ca o reacție chimică să aibă loc. Dar coliziunea nu este suficientă pentru ca reactanții să fie transformați în produse. Moleculele trebuie să aibă suficientă energie și trebuie să se ciocnească cu orientarea spațială corectă. după cum probabil știți deja, există diferite tipuri de reacții, inclusiv sinteza, descompunerea, deplasarea și arderea., Având în vedere faptul că teoria coliziunii se concentrează asupra reacțiilor care implică coliziuni între două specii, nu trebuie să vă faceți griji prea mult despre reacțiile de descompunere, deoarece, în astfel de cazuri, un singur compus este destrămat și nu este necesar să se ia în considerare coliziunile sau orientarea particulelor în spațiu. în cazul reacțiilor care implică două specii, coliziunile dintre molecule sunt cruciale pentru ca reacția să continue; dar numai coliziunile moleculelor cu suficientă energie cinetică și Orientare spațială relevantă pot provoca o reacție., Astfel, energia este necesară pentru a rupe legăturile din moleculele care reacționează, în timp ce orientarea moleculelor în spațiu joacă un rol important în alinierea atomilor adecvați unul cu celălalt pentru a reforma legăturile rupte în mod corespunzător. când ambele criterii sunt îndeplinite, coliziunea este considerată o coliziune reușită, eficientă sau reactivă. având în vedere importanța celor doi factori menționați mai sus (energie și orientare), ar trebui să continuăm explicarea ulterioară a termenilor și conceptelor pentru a înțelege mai bine principiile teoriei coliziunii., după cum am menționat deja mai devreme, particulele trebuie să se ciocnească cu suficientă energie pentru ca o reacție să apară. Această energie minimă necesară pentru reacția de a continua este definită ca energia de activare.,
după Cum știți, există două tipuri de reacții privind eliberarea de energie sau de absorbție, care sunt următoarele:
- reacția Endotermă – energie este absorbită într-o reacție (de obicei sub formă de căldură)
- reacție Exotermă – energia este eliberată într-o reacție (de obicei sub formă de căldură)
La prima vedere, s-ar părea că de vreme ce energia este eliberată într-o reacție exotermă, nu ar trebui să fie nici o nevoie de a introduce unele de energie pentru reacția să aibă loc. Dimpotrivă, ambele reacții chimice endotermice și exoterme necesită energie pentru a începe.,
pare un pic ciudat, nu? De ce o reacție are nevoie de aportul de energie dacă energia este eliberată în consecință? să luăm în considerare următoarele exemple de reacții exoterme care apar în viața noastră de zi cu zi.

Exemplu #1 – Arderea unei Lumânări
arderea unei lumânări eliberează energie sub formă de căldură; prin urmare, reacția care au loc în timpul procesului este exotermă. Evident, trebuie să aprindeți lumânarea folosind un chibrit sau o brichetă., Ce înseamnă asta este că trebuie să introduceți ceva energie pentru ca lumânarea să se aprindă. După aceea, reacția are suficientă energie pentru a trece la pașii următori, iar lumânarea continuă să ardă energie. cu toate acestea, o lumânare nu va izbucni niciodată în flăcări pe cont propriu, nu?
Exemplu #2 – aprind un Chibrit

tipic pentru Un meci este compus din sulf amestecate cu diferiți agenți oxidanți. Pentru a aprinde chibritul, ar trebui să frecați capul meciului de partea specială a unei cutii de chibrituri., În timpul acestui proces, are loc o reacție și eliberează energie sub formă de lumină și căldură. Astfel, reacția este considerată exotermă. Deși, mai trebuie să introduceți ceva energie pentru ca chibritul să înceapă să ardă. Această energie este definită prin termenul ” energie de activare.”Similar cu exemplul anterior, atâta timp cât furnizați suficientă energie pentru ca chibritul să se aprindă, acesta va continua să ardă și să elibereze căldura pe cont propriu. graficul energiei de activare descrie schimbările de energie care apar în timpul unei reacții chimice.,
Pentru complot energia de activare grafic, este esențial să se ia în considerare două variabile:
- Numărul de ciocniri între molecule diferite
- energia Cinetică a ciocnesc moleculele
prima variabilă este destul de ușor de înțeles, deoarece are o semnificație directă – aceasta definește numărul de coliziuni între particule de două specii pe secundă. a doua variabilă este energia cinetică a moleculelor care se ciocnesc, care poate fi definită ca energia mișcării moleculelor.reacția endotermică – energia este absorbită., Energia reactanților este mai mică decât energia produselor.
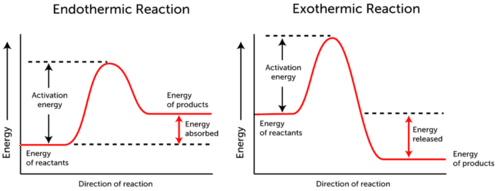
- Reacție Exotermă – energia este eliberată. Energia reactanților este mai mult decât energia produselor. după cum puteți vedea în cele două grafice de mai sus, energia de activare pentru ambele reacții endotermice și exoterme este aceeași.,deoarece reacția endotermică nu poate produce atâta energie cât trebuie să consume pentru ca reacția să aibă loc, energia este absorbită; prin urmare, energia produselor este mai mare decât energia reactanților.dimpotrivă, reacțiile exoterme produc mai multă energie decât folosesc ca energie de activare. Ca urmare, energia este eliberată, iar produsele au o energie mai mică decât reactanții., ca o concluzie ,se poate afirma că, chiar dacă moleculele reactante se ciocnesc rapid între ele, este esențial ca moleculele să aibă suficientă energie pentru ca reacția să aibă loc.conform teoriei coliziunii, nu toate coliziunile au succes, chiar dacă moleculele reactantului au suficientă energie de activare. Moleculele trebuie, de asemenea, să se ciocnească în mod corect. deci, al doilea aspect care influențează coliziunile reactive este considerat orientarea spațială (orientarea moleculelor în spațiu)., ce se înțelege prin orientarea „corectă” a moleculelor într-o reacție?când două molecule se ciocnesc, ambele molecule trebuie să fie situate în modul în care le este ușor să reacționeze. Pentru a înțelege pe deplin conceptul, este important să evidențiem mecanismul reacției.
Să considerăm reacția dintre propilenă (sau propenă) și bromură de hidrogen ca un exemplu:

Jim Clark după Cum puteți vedea mai sus, reacția încasările în 2 etape.,
Pasul 1: legătura dublă este ruptă
Pasul 2: bromul este atașat
în această reacție, orientările moleculare ale HBr și C3H6 joacă un rol important, deoarece una dintre ele a fost situată într-o altă manieră, nu ar fi fost posibil ca atomul H să se apropie de molecula de propilenă. acest lucru este valabil pentru fiecare reacție. Fiecare moleculă trebuie să aibă orientarea corectă în spațiu pentru ca reacția să aibă loc. Orientarea corectă asigură faptul că moleculele sunt situate în modul în care este relativ ușor pentru ei să se ciocnească și să reacționeze., putem concluziona că orientarea favorabilă a moleculelor reactante este la fel de esențială ca energia de activare suficientă.
Sumar
Termeni și concepte definite, pe parcursul articolului, sunt prezentate sintetic în tabelul de mai jos:
Teoria Coliziune Explică modul în care particulele interacționează sau cu alte fiecare pentru a provoca o reacție., Conform teoriei coliziunii, două criterii trebuie îndeplinite pentru ca o reacție chimică să aibă loc: moleculele trebuie să se ciocnească cu suficientă energie de activare pentru a rupe și re-forma legăturile existente; moleculele trebuie să se ciocnească cu o orientare spațială favorabilă.coliziunea reușită (denumită și coliziune eficientă sau reactivă) o coliziune a moleculelor cu suficientă energie de activare și orientare adecvată în spațiu care are ca rezultat o reacție chimică., energie de activare energia minimă necesară pentru ca reacția să apară. Aportul de energie este necesar în cazul reacțiilor endotermice și exoterme. reacția endotermică energia (căldura) este absorbită; energia reactanților este mai mică decât energia produselor; nu poate produce atâta energie cât consumă în timpul reacției., reacția exotermă energia (căldura) este eliberată; energia reactanților este mai mare decât energia produselor; poate produce mai multă energie decât consumă în timpul reacției. orientarea moleculară orientarea spațială a moleculelor., Three different scenarios are represented in the picture attached below:
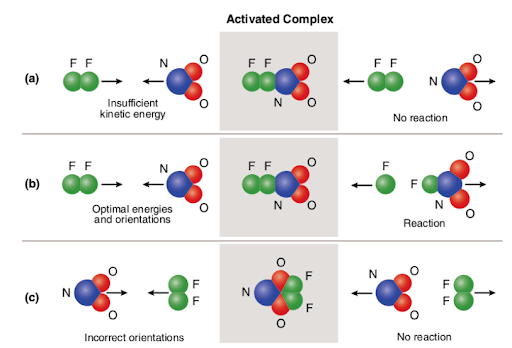
OpenStax College The picture summarizes the concept of collision theory utilizing two reactant molecules (fluorine (F2) and molecular nitrogen dioxide (NO2)) and three different cases to form nitrogen oxyfluoride., în cazul (a), moleculele reactante au o orientare spațială adecvată, dar nu au suficientă energie de activare; prin urmare, reacția nu apare datorită faptului că nu există suficientă energie pentru a rupe legăturile. Deci, coliziunea dintre cele două molecule este considerată nereactivă.
în cazul (b), moleculele reactante au atât energie de activare suficientă, cât și orientare adecvată în spațiu. Datorită caracteristicilor optime ale moleculelor, reacția are loc și se formează oxifluorură de azot., Deci, coliziunea dintre cele două molecule este considerată reactivă.
în cazul lui (c), moleculele reactantului au suficientă energie de activare, dar nu sunt situate corespunzător în spațiu; prin urmare, reacția nu are loc, deoarece nu este posibil ca moleculele să ajungă una la alta în modul în care rupe legăturile. Deci, în mod similar cu primul caz, coliziunea dintre cele două molecule este considerată nereactivă.