Richard Baxter și Jim Britton
cum corodează oțelul în apă?pentru a înțelege protecția catodică, trebuie să înțelegeți mai întâi cum este cauzată coroziunea. Pentru ca coroziunea să apară, trebuie să existe trei lucruri:
1. Două metale diferite
2. Un electrolit (apă cu orice tip de sare sau săruri dizolvate în el)
3., O cale metalică (conductoare) între metalele diferite
cele două metale diferite pot fi aliaje Total diferite – cum ar fi oțelul și aluminiul – dar sunt mai susceptibile de a fi diferențe metalurgice microscopice sau macroscopice pe suprafața unei singure bucăți de oțel. În acest caz, vom lua în considerare oțelul care corodează liber, care este neuniform.dacă există condițiile de mai sus, următoarea reacție are loc la locurile mai active: (doi ioni de fier plus patru electroni liberi).,
2Fe => 2Fe++ + 4e-
electronii liberi călătorie prin metal calea cea mai puțin activă site-uri, în cazul în care următoarea reacție are loc: (oxigen gaz este transformat în oxigen ion – prin combinarea cu patru electroni liberi – care se combina cu apa pentru a forma ioni de hidroxil).
O2 + 4e- + 2H20 => 4 OH-
re-combinări ale acestor ioni la suprafața activă a produce următoarea reacție, care dă fier-coroziune produs hidroxid feros: (fier combinarea cu oxigen și apă pentru a forma hidroxid feros).,
2Fe + O2 + 2H2O => 2Fe (OH)2
Această reacție este mai frecvent descris ca ‘fluxul de curent prin apa de la anod (mai activ site-ul) la catod (mai puțin activă a site-ului).”
cum oprește protecția catodică coroziunea?protecția catodică previne coroziunea prin transformarea tuturor siturilor anodice (active) de pe suprafața metalică în situri catodice (pasive) prin furnizarea de curent electric (sau electroni liberi) dintr-o sursă alternativă.de obicei, aceasta ia forma anodelor galvanice, care sunt mai active decât oțelul., Această practică este denumită și un sistem sacrificial, deoarece anozii galvanici se sacrifică pentru a proteja oțelul structural sau conducta de coroziune.
În caz de anozi aluminiu, reacția la suprafața de aluminiu este: (patru ioni de aluminiu plus doisprezece electroni liberi)
4Al => 4AL+++ + 12 e-
și la suprafața de oțel: (oxigen gaz convertit la ioni de oxigen care se combina cu apa pentru a forma ioni de hidroxil).,
3O2 + 12e- + 6H20 => 12OH-
Cât de mult curent (electroni liberi) ajunge la catod (oțel) mai repede decât oxigenul ajunge, nu coroziunea se va produce.,
considerente de Bază la proiectarea anod de sacrificiu sisteme
curentul electric un anod evacuările este controlată de legea lui Ohm, care este:
I=E/R
I= fluxul de Curent în amperi
E= Diferența de potențial între anod și catod în volți,
R= circuit Total rezistența în ohmi
Inițial, curentul va fi mare, deoarece diferența de potențial între anod și catod sunt mari, dar ca diferența de potențial scade ca urmare a efectului de fluxul de curent pe catod, curentul scade treptat din cauza polarizare a catodului., Rezistența circuitului include atât calea de apă, cât și calea metalică, care include orice cablu din circuit. Valoarea dominantă aici este rezistența anodului la apa de mare.pentru majoritatea aplicațiilor, rezistența metalului este atât de mică în comparație cu rezistența la apă încât poate fi ignorată (deși acest lucru nu este valabil pentru sănii sau conducte lungi protejate de ambele capete). În general, anozi lungi, subțiri au o rezistență mai mică decât anozi scurt, grăsime. Acestea vor descărca mai mult curent, dar nu vor dura atât de mult.,prin urmare, un designer de protecție catodică trebuie să dimensioneze anodii astfel încât să aibă forma și suprafața potrivită pentru a descărca suficient curent pentru a proteja structura și greutatea suficientă pentru a dura durata de viață dorită la descărcarea acestui curent.
ca regulă generală:
lungimea anodului determină cât de mult curent poate produce anodul și, în consecință, câte picioare pătrate de oțel pot fi protejate. Secțiunea transversală (greutatea) determină cât timp anodul poate susține acest nivel de protecție.,
sisteme de protecție catodică cu curent impresionat (sisteme anodice ICCP)
datorită curenților mari implicați în multe sisteme de apă de mare, nu este neobișnuit să se utilizeze sisteme cu curent impresionat care utilizează anozi de un tip (anozi ICCP) care nu sunt ușor dizolvați în ioni metalici. Aceasta determină o reacție alternativă: oxidarea ionilor de clorură dizolvați.
2CL- => Cl2 + 2E-
puterea este furnizată de o unitate externă de curent continuu.,

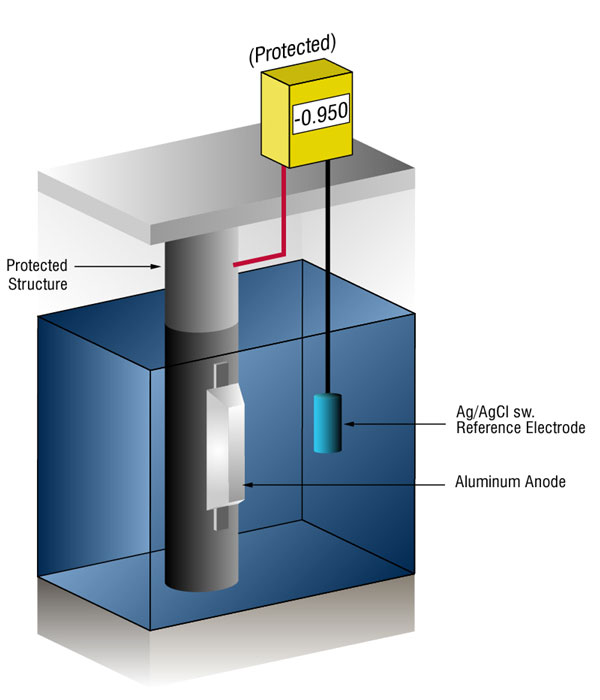
cum știm când avem suficientă protecție catodică?
putem verifica dacă există suficient curent prin măsurarea potențialului oțelului față de un electrod de referință standard, de obicei argint argint/clorură (Ag/AgCl SW.), dar uneori zinc (sw.).
fluxul de curent pe orice metal își va schimba potențialul normal în direcția negativă. Istoria a arătat că dacă oțelul primește suficient curent pentru a schimba potențialul la ( – ) 0.800 v vs., silver / silver chloride (Ag / AgCl), the corrosion is essentially stopped.
 |
 |