obiective de învățare
- Pentru a obține o înțelegere a teoriei coliziunii.
- pentru a obține o înțelegere a celor patru factori principali care afectează rata de reacție.cinetica reacției este studiul ratei reacțiilor chimice, iar ratele de reacție pot varia foarte mult pe o gamă largă de scale de timp. Unele reacții se pot desfășura la viteze explozive rapide, cum ar fi detonarea artificiilor (Figura 17.,1 „focuri de artificii pe timp de noapte peste râu”), în timp ce altele pot apărea într-un ritm lent pe parcursul mai multor ani, cum ar fi ruginirea sârmei ghimpate expuse elementelor (figura 17.2 „sârmă ghimpată ruginită”).
figura 17.1. Focuri de artificii pe timp de noapte peste râu

reacția chimică în focuri de artificii se întâmplă la o rată explozivă.figura 17.2. Sârmă ghimpată ruginită

ruginirea sârmei ghimpate are loc pe parcursul mai multor ani.,pentru a înțelege cinetica reacțiilor chimice și factorii care afectează cinetica, ar trebui să examinăm mai întâi ce se întâmplă în timpul unei reacții la nivel molecular. Conform teoriei coliziunii reactivității, reacțiile apar atunci când moleculele reactante ” se ciocnesc efectiv.”Pentru a avea loc o” coliziune eficientă”, moleculele reactante trebuie orientate corect în spațiu pentru a facilita ruperea și formarea legăturilor și rearanjarea atomilor care au ca rezultat formarea moleculelor de produs (figura 17.3″vizualizări de coliziune”).figura 17.3., Vizualizarea coliziunilor
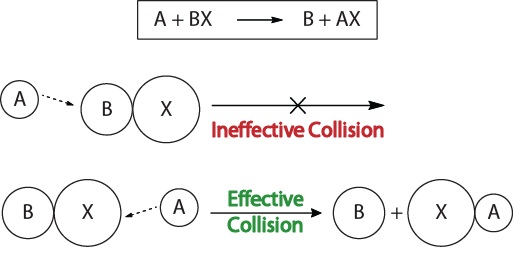
această vizualizare arată o coliziune ineficientă și eficientă bazată pe orientarea moleculară.în timpul unei coliziuni moleculare, moleculele trebuie să posede, de asemenea, o cantitate minimă de energie cinetică pentru a avea loc o coliziune eficientă. Această energie variază pentru fiecare reacție și este cunoscută sub numele de energie de activare (Ea) (figura 17.4 „energie potențială și energie de activare”)., Prin urmare, rata de reacție depinde de energia de activare; o energie de activare mai mare înseamnă că mai puține molecule vor avea suficientă energie pentru a suferi o coliziune eficientă.figura 17.4. Energia potențială și Energia de Activare
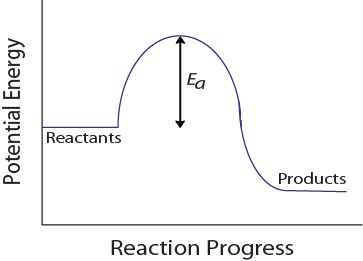
Această energie potențială diagramă arată energia de activare a unei ipotetice reacție. Factori Care Afectează Rata
Există patru factori principali care pot afecta reacția rata de o reacție chimică:
1. Concentrația reactantului., Creșterea concentrației unuia sau mai multor reactanți va crește adesea rata de reacție. Acest lucru se întâmplă deoarece o concentrație mai mare a unui reactant va duce la mai multe coliziuni ale reactantului într-o anumită perioadă de timp.
2. Starea fizică a reactanților și a suprafeței. Dacă moleculele reactante există în diferite faze, ca într-un amestec eterogen, rata de reacție va fi limitată de suprafața fazelor care sunt în contact., De exemplu, dacă se amestecă un reactant metalic solid și un reactant de gaz, numai moleculele prezente pe suprafața metalului sunt capabile să se ciocnească cu moleculele de gaz. Prin urmare, creșterea suprafeței metalului prin lovirea acestuia plat sau tăierea acestuia în mai multe bucăți va crește rata de reacție.
3. Temperatura. O creștere a temperaturii crește de obicei rata de reacție. O creștere a temperaturii va ridica energia cinetică medie a moleculelor reactante., Prin urmare, o proporție mai mare de molecule va avea energia minimă necesară pentru o coliziune eficientă (figura. 17.5 „temperatura și viteza de reacție”).
figura. 17.5 Temperatura și viteza de Reacție
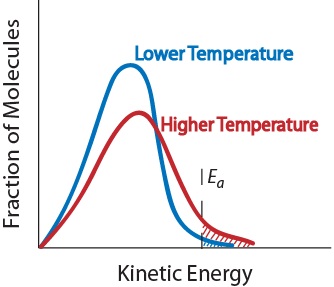
Efectul temperaturii asupra energiei cinetice de distribuție a moleculelor într-un eșantion 4. Prezența unui catalizator. Un catalizator este o substanță care accelerează o reacție prin participarea la ea fără a fi consumată. Catalizatorii oferă o cale alternativă de reacție pentru a obține produse., Ele sunt critice pentru multe reacții biochimice. Acestea vor fi examinate în continuare în secțiunea „cataliză.”
Takeaways cheie
- reacțiile apar atunci când două molecule reactant se ciocnesc în mod eficient, fiecare având energie minimă și orientare corectă.
- concentrația reactantului, starea fizică a reactanților și suprafața, temperatura și prezența unui catalizator sunt cei patru factori principali care afectează viteza de reacție.