10.2 Brønsted-Lowry Definiția Acizilor și Bazelor
Obiectivele de Învățare
- Recunoască un compus ca un Brønsted-Lowry acid sau o Brønsted-Lowry bază.
- ilustrați procesul de transfer de protoni care definește o reacție acido-bazică Brønsted-Lowry.
amoniacul (NH3) crește concentrația ionilor de hidroxid în soluție apoasă prin reacția cu apa, mai degrabă decât prin eliberarea directă a ionilor de hidroxid., De fapt, definițiile Arrhenius ale unui acid și ale unei baze se concentrează asupra ionilor de hidrogen și a ionilor de hidroxid. Există mai multe definiții fundamentale pentru acizi și baze?în 1923, omul de știință danez Johannes Brønsted și omul de știință englez Thomas Lowry au propus în mod independent noi definiții pentru acizi și baze. În loc să ia în considerare atât ionii de hidrogen, cât și ionii de hidroxid, ei s-au concentrat doar pe ionul de hidrogen. Un compus acida Brønsted-Lowry care furnizează un ion de hidrogen (H+) într-o reacție; un donator de protoni. este un compus care furnizează un ion de hidrogen într-o reacție., O bază Brønsted-Lowry un compus care acceptă un ion de hidrogen (H+) într-o reacție; un acceptor de protoni., dimpotrivă, este un compus care acceptă un ion de hidrogen într-o reacție. Astfel, definițiile Brønsted-Lowry ale unui acid și ale unei baze se concentrează asupra mișcării ionilor de hidrogen într-o reacție, mai degrabă decât asupra producției de ioni de hidrogen și ioni de hidroxid într-o soluție apoasă.să folosim reacția amoniacului în apă pentru a demonstra definițiile Brønsted-Lowry ale unui acid și ale unei baze., Amoniac și moleculele de apă sunt reactanți, în timp ce ion de amoniu și hidroxid de ion sunt produse:
NH3(aq) + H2O(ℓ) → NH4+(aq) + OH−(aq)
Ce s-a întâmplat în această reacție este că inițial moleculă de apă a donat un ion de hidrogen original molecula de amoniac, care la rândul său a acceptat ioni de hidrogen. Putem ilustra acest lucru, după cum urmează:
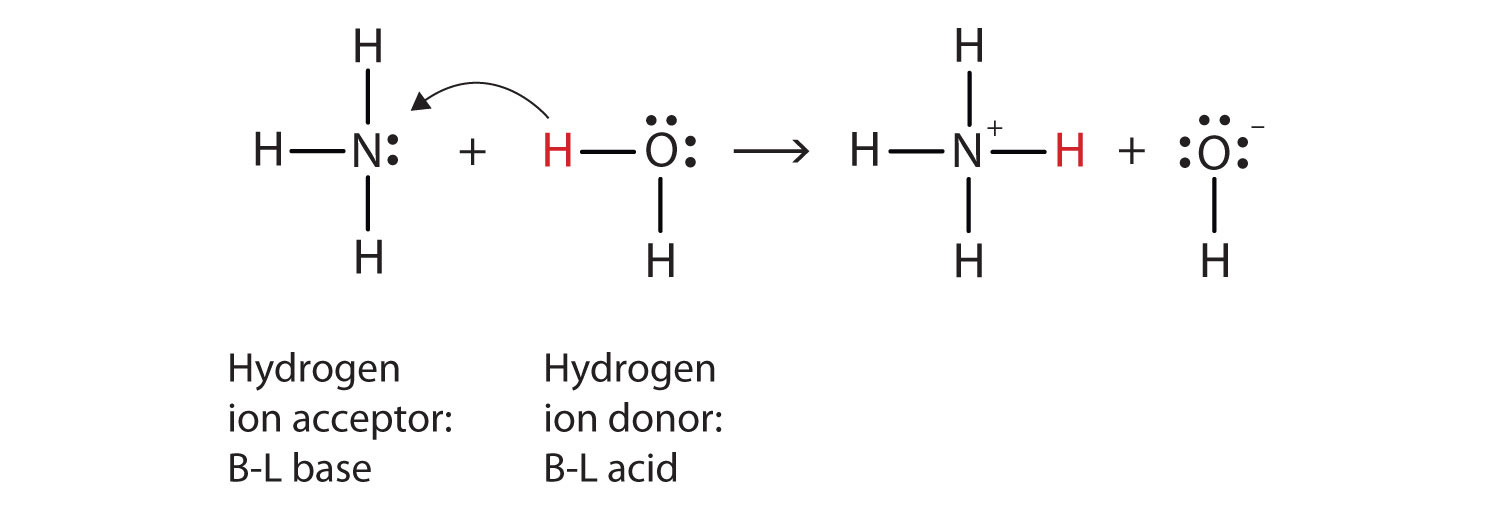
Deoarece molecula de apă donează un ion de hidrogen la amoniac, este Brønsted-Lowry acid, în timp ce molecula de amoniac—care acceptă ioni de hidrogen—este Brønsted-Lowry bază., Astfel, amoniacul acționează ca bază atât în sensul Arrhenius, cât și în sensul Brønsted-Lowry.
este un acid Arrhenius ca acidul clorhidric încă un acid în sensul Brønsted-Lowry? Da, dar ne cere să înțelegem ce se întâmplă cu adevărat atunci când HCl este dizolvat în apă. Reamintim că atomul de hidrogen este un singur proton înconjurat de un singur electron. Pentru a face ionul de hidrogen, scoatem electronul, lăsând un proton gol. Chiar avem protoni goi plutind în soluție apoasă? Nu, nu avem., Ceea ce se întâmplă cu adevărat este că ionul H+ se atașează de H2O pentru a face H3O+, care se numește ionul hidroniu. În majoritatea scopurilor, H+ și H3O + reprezintă aceeași specie, dar scrierea H3O+ în loc de H+ arată că înțelegem că nu există protoni goi care plutesc în soluție. Mai degrabă, acești protoni sunt de fapt atașați moleculelor de solvent.
Nota
Un protoni în soluție apoasă pot fi înconjurat de mai mult de o moleculă de apă, ceea ce duce la formule ca H5O2+ sau H9O4+ mai degrabă decât de H3O+. Cu toate acestea, este mai simplu să folosiți H3O+.,având în vedere acest lucru, cum definim HCl ca acid în sensul Brønsted-Lowry? Luați în considerare ceea ce se întâmplă atunci când HCl se dizolvă în H2O:
HCl + H2O(ℓ) → H3O+(aq) + Cl−(aq)
putem descrie acest proces folosind Lewis electron punct de diagrame:
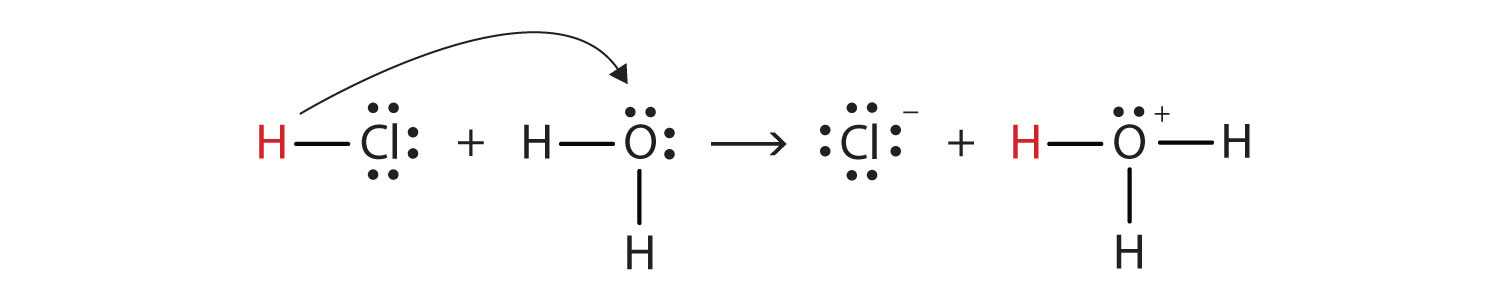
Acum vom vedea că un ion de hidrogen este transferat de la HCl molecula la molecula H2O pentru a face ionii de clor și hydronium ioni. Ca donator de ioni de hidrogen, HCl acționează ca un acid Brønsted-Lowry; ca acceptor de ioni de hidrogen, H2O este o bază Brønsted-Lowry., Deci HCl este un acid nu doar în sensul Arrhenius, ci și în sensul Brønsted-Lowry. Mai mult, prin definițiile Brønsted-Lowry, H2O este o bază în formarea HCl apoasă. Deci Brønsted-Lowry definiții dintre un acid și o bază clasifica dizolvarea HCl în apă ca o reacție dintre un acid și o bază—deși Arrhenius definiție nu ar fi etichetat H2O o bază în această circumstanță.
notă
toți acizii și bazele Arrhenius sunt, de asemenea, acizi și baze Brønsted-Lowry. Dar nu toți acizii și bazele Brønsted-Lowry sunt acizi și baze Arrhenius.,
Exemplul 3
Anilina (C6H5NH2) este ușor solubilă în apă. Are un atom de azot care poate accepta un ion de hidrogen dintr-o moleculă de apă la fel ca atomul de azot din amoniac. Scrieți ecuația chimică pentru această reacție și identificați acidul și baza Brønsted-Lowry.C6H5NH2 și H2O sunt reactanții. Când c6h5nh2 acceptă un proton de la H2O, acesta câștigă un H suplimentar și o sarcină pozitivă și lasă un oh− ion în urmă., Reacția este după cum urmează:
C6H5NH2(aq) + H2O(ℓ) → C6H5NH3+(aq) + OH−(aq)
Pentru C6H5NH2 acceptă un proton, este Brønsted-Lowry bază. Molecula H2O, deoarece donează un proton, este acidul Brønsted-Lowry.
exercițiu de construire a abilităților
-
cofeina (C8H10N4O2) este un stimulent găsit în cafea și ceaiuri. Când este dizolvat în apă, poate accepta un proton dintr-o moleculă de apă. Scrieți ecuația chimică pentru acest proces și identificați acidul și baza Brønsted-Lowry.,definițiile Brønsted-Lowry ale unui acid și ale unei baze pot fi aplicate reacțiilor chimice care apar în alți solvenți decât apa. Exemplul următor ilustrează.
Exemplul 4
Amida de sodiu (NaNH2) se dizolvă în metanol (CH3OH) și se separă în ioni de sodiu și ioni de amidă (NH2−). Ionii de amidă reacționează cu metanolul pentru a produce amoniacul și ionul de metoxid (CH3O−). Scrieți o ecuație chimică echilibrată pentru acest proces și identificați acidul și baza Brønsted-Lowry.,
Soluție
ecuația de reacție este între NH2− și CH3OH pentru a face NH3 și CH3O− este, după cum urmează:
NH2−(solv) + CH3OH(ℓ) → NH3(solv) + CH3O−(solv)
eticheta (solv) indică faptul că speciile sunt dizolvate într-un solvent, în contrast cu (aq), care specifică o soluție apoasă (H2O) soluție. În această reacție, vedem că ionul NH2 acceptă un proton dintr-o moleculă CH3OH pentru a face o moleculă NH3. Astfel, ca acceptor de protoni, NH2− este baza Brønsted-Lowry. Ca donator de protoni, CH3OH este acidul Brønsted-Lowry.,
Construirea de Calificare Exercițiu
-
Pyridinium clorură (C5H5NHCl) se dizolvă în etanol (C2H5OH) și se separă în pyridinium ioni (C5H5NH+) și ioni de clorură. Ionul de piridiniu poate transfera un ion de hidrogen într-o moleculă de solvent. Scrieți o ecuație chimică echilibrată pentru acest proces și identificați acidul și baza Brønsted-Lowry.
Pentru Sănătatea Ta: Brønsted-Lowry Acid-Bază Reacții în produse Farmaceutice
Există multe aplicații interesante de Brønsted-Lowry acid-bază reacții în industria farmaceutică., De exemplu, medicamentele trebuie adesea solubile în apă pentru o eficiență maximă. Cu toate acestea, mulți compuși organici complexi nu sunt solubili sau sunt doar puțin solubili în apă. Din fericire, acele medicamente care conțin atomi de azot care acceptă protoni (și există o mulțime de ele) pot fi reacționate cu acid clorhidric diluat . Atomii de azot-acționând ca baze Brønsted—Lowry-acceptă ionii de hidrogen din acid pentru a face un ion, care este de obicei mult mai solubil în apă., Modificat de droguri molecule apoi pot fi izolate ca clorură de săruri:
RN(aq aq) + H+(aq) → RNH+(aq) →Cl−(aq) RNHCl(s)
în cazul în care RN reprezintă un compus organic care conține azot. Eticheta (sl aq) înseamnă „ușor apoasă”, indicând faptul că compusul RN este doar puțin solubil. Medicamentele care sunt modificate în acest mod se numesc săruri de clorhidrat. Exemplele includ codeina puternic analgezic, care este frecvent administrat ca clorhidrat de codeină. Se utilizează, de asemenea, acizi, alții decât acidul clorhidric. Acidul bromhidric, de exemplu, dă săruri de bromhidrat., Dextrometorfanul, un ingredient în multe medicamente pentru tuse, este distribuit sub formă de bromhidrat de dextrometorfan. Figura însoțitoare arată un alt medicament sub formă de sare de clorhidrat.
denumirea acestui medicament arată clar că există sub formă de sare clorhidrat.
© Thinkstock
Conceptul Exercițiu de Revizuire
-
Da definiții de un Brønsted-Lowry acid Brønsted-Lowry bază.,
Răspunsul
-
un Brønsted-Lowry acid este un donator de protoni, în timp ce un Brønsted-Lowry bază este un acceptor de protoni.
Takeaways Cheie
- un Brønsted-Lowry acid este un donator de protoni, și o Brønsted-Lowry bază este un acceptor de protoni.
- reacțiile acido-bazice Brønsted-Lowry sunt în esență reacții de transfer de protoni.
Exerciții
-
Eticheta fiecare reactive ca un Brønsted-Lowry acid sau o Brønsted-Lowry bază.,
HCl (aq) + NH3(AQ) → NH4 + (AQ) + Cl−(AQ)
-
Eticheta fiecare reactive ca un Brønsted-Lowry acid sau o Brønsted-Lowry bază.
H2O(ℓ)+N2H4(AQ) → N2H5 + (aq) + OH−(AQ)
-
Explica de ce un Brønsted-Lowry acid poate fi numit un donator de protoni.
-
explicați de ce o bază Brønsted-Lowry poate fi numită acceptor de protoni.
-
scrieți ecuația chimică a reacției amoniacului în apă și etichetați acidul și baza Brønsted-Lowry.,
-
Scrieți ecuația chimică a reacției dintre metilamină (CH3NH2) în apă și eticheta Brønsted-Lowry acid și de bază.
-
Demonstreze că dizolvarea de HNO3 în apă este de fapt o Brønsted-Lowry reacție acido-bazic, descriind cu o ecuație chimică și etichetarea Brønsted-Lowry acid și de bază.,
-
Identifica Brønsted-Lowry acid și de bază în următoarea ecuație chimică:
C3H7NH2(aq) + H3O+(aq) → C3H7NH3+(aq) + H2O(ℓ)
-
Scrie ecuația chimică pentru reacția care apare atunci când clorhidratul de cocaină (C17H22ClNO4) se dizolvă în apă și donează un proton de la o moleculă de apă. (Când hidrocloridele se dizolvă în apă, ele se separă în ioni de clor și cationul corespunzător.dacă bromhidratul de codeină are formula C18H22BrNO3, care este formula compusului părinte codeină?,
-