Categorie: Chimie
publicat: decembrie 9, 2013
da, apa poate rămâne lichid sub zero grade Celsius. Există câteva moduri în care acest lucru se poate întâmpla.
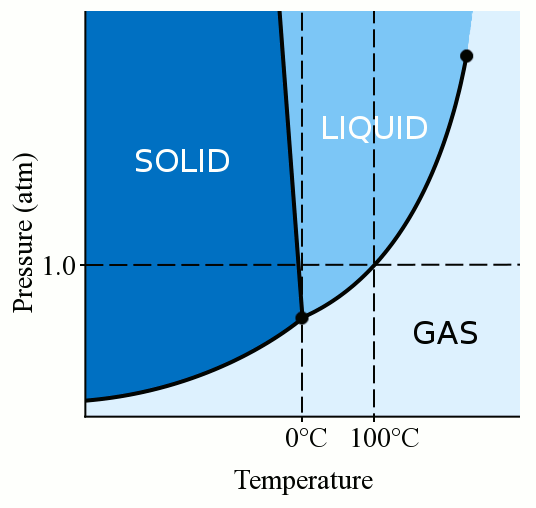
punctul de îngheț al apei scade sub zero grade Celsius, cât se aplică presiune. Imaginea domeniului Public, sursa: Christopher S. Baird.în primul rând, faza unui material (indiferent dacă este gaz, lichid sau solid) depinde puternic atât de temperatură, cât și de presiune., Pentru majoritatea lichidelor, aplicarea presiunii ridică temperatura la care lichidul îngheață la solid. Un solid se formează atunci când moleculele libere, meandre ale unui lichid devin suficient de lente și destul de apropiate pentru a forma legături stabile care le fixează în poziție. Când aplicăm presiune asupra unui lichid, forțăm moleculele să se apropie. Prin urmare, ele pot forma legături stabile și pot deveni solide chiar dacă au o temperatură mai mare decât punctul de îngheț la presiune standard. Apa este oarecum unic, deși. Moleculele de apă se răspândesc atunci când se leagă într-o structură cristalină solidă., Această acțiune de împrăștiere face ca gheața să fie mai puțin densă decât apa lichidă, determinând gheața să plutească. Această acțiune de răspândire a moleculelor de apă în timpul înghețării înseamnă, de asemenea, că aplicarea presiunii asupra apei scade punctul de îngheț. Dacă aplicați suficientă presiune (ceea ce face greu ca moleculele de apă să se răspândească în structura solidă), puteți avea apă lichidă cu câteva grade sub zero grade Celsius.chiar dacă nu aplicați presiune, puteți avea în continuare apă lichidă la temperaturi sub zero folosind aditivi., Aditivii, cum ar fi sarea, pot interfera cu Lipirea chimică necesară pentru a forma un solid și, prin urmare, pot scădea punctul de îngheț al apei. Sarea este compusă din ioni puternici de sodiu și clor. Când se dizolvă în apă, moleculele de apă tind să se lipească de ionii de sare în loc să se lipească unul de celălalt și, prin urmare, nu îngheață la fel de ușor. Pe măsură ce adăugați mai multă sare în apă, punctul său de îngheț continuă să scadă până când apa ajunge la saturație și nu mai poate reține sare. Dacă adăugați suficientă sare, punctul de îngheț al apei poate fi scăzut până la -21 grade Celsius., Acest fapt înseamnă că apa la -21 grade Celsius poate rămâne lichidă dacă se adaugă suficientă sare. În loc să împiedice înghețarea apei lichide, Această proprietate puternică a sării poate fi folosită și pentru a transforma gheața înapoi în apă. Stropirea sării pe trotuarele înghețate scade punctul de îngheț al gheții sub temperatura ambiantă și gheața se topește. Dar stropirea sării pe pasarele înghețate nu va ajuta dacă temperatura ambiantă este sub -21 grade Celsius. Efectul sării asupra punctului de îngheț al apei are, de asemenea, efecte profunde asupra oceanelor Pământului.,chiar dacă nu aplicați presiune și nu adăugați nimic în apă, puteți avea în continuare apă lichidă la temperaturi sub zero grade Celsius. Pentru ca apa să înghețe la gheață, are nevoie de ceva pe care să înghețe pentru a începe procesul. Numim aceste puncte de plecare „centre de nucleație”. În cele mai multe situații, un pic de praf, impuritate sau chiar mici vibrații în apă furnizează centre de nucleație pentru ca apa să înghețe. Dar dacă apa voastră este foarte pură și nemișcată, nu există nimic pe care moleculele de apă să cristalizeze., Drept urmare, puteți răci apă foarte pură cu mult sub zero grade Celsius, fără a îngheța. Apa în această stare se numește „supercooled”. La presiunea standard, apa pură poate fi suprarăcită până la aproximativ -40 grade Celsius. Apa suprarăcită este împiedicată să înghețe numai prin lipsa centrelor de nucleație. Prin urmare, odată ce sunt furnizate centre de nucleație (care ar putea fi la fel de simple ca o vibrație), apa supracoate îngheață rapid. Ploaia înghețată este un exemplu natural de apă lichidă suprarăcită., Odată ce ploaia înghețată lovește un obiect de pe suprafața Pământului, acel obiect furnizează centre de nucleație, iar ploaia îngheață la gheață.
subiecte: congelare, punct de congelare, ploaie de congelare, gheață, diagrama de fază, presiune, suprarăcit, temperatură, apă