până acum, ne-am uitat la moduri în care perechi de orbitali atomici ar putea combina pentru a forma orbitali moleculari — de a forma legături. La fel cum ne gândim că există o progresie a orbitalilor atomici de la cea mai mică energie la cea mai mare (1s, 2s, 2p, 3s…), putem organiza aceste orbite moleculare prin Ordinul energiei lor.într-o mare măsură, ordinea orbitalilor moleculari în energie poate fi considerată a urma din ordinea orbitalilor atomici din care sunt construiți., Există unele abateri de la această regulă, uneori, dar asta e cel mai simplu loc pentru a începe. Deci, într-o moleculă, orbitalii moleculari cu cea mai mică energie ar fi cei formați din orbitalii atomici cu cea mai mică energie, orbitalii 1s.
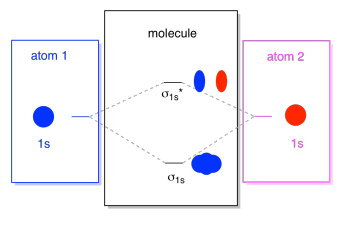
ceea ce vedem aici este o diagramă de interacțiune orbitală moleculară. Mijlocul diagramei este doar diagrama energiei orbitale moleculare. Este analog cu diagrama energiei orbitale atomice (care merge 1s, 2s, 2p, 3s…). Ordinea energiei până acum este σ1s, σ1s*., Laturile diagramei se referă doar la locul de unde au venit orbitalii moleculari, cu linii punctate pentru a vă ghida dintr-un loc în altul. În total, imagine spune că orbital 1s pe un atom și orbital 1s pe celălalt atom pot combina în două moduri diferite, care produc mai mici de energie, lipire σ1s și energie mai mare, antibonding σ1s*.rețineți că nu am adăugat încă electroni la acea diagramă a energiei orbitale moleculare, dar când o vom face, îi vom completa doar de jos în sus, la fel cum am face o diagramă a energiei orbitale atomice.,
următorul set cel mai mic de orbitale atomice este nivelul 2s. Aceste orbite sferice s-ar combina foarte mult ca orbitalii 1s, și am obține o diagramă similară, doar la un nivel de energie ușor mai ridicat.
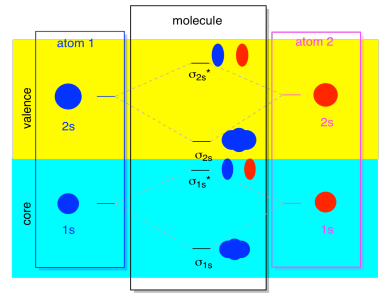
cele Mai multe ori, nu vom vedea atât σ1s și σ2s afișate în diagramă. Asta pentru că dacă există electroni 2s, atunci acei electroni 1s sunt cu adevărat electroni de bază, nu valență. Sunt îngropați puțin mai adânc în atom și nu joacă un rol foarte important în legătură., Ignorând bază de electroni este destul de comună; dacă vă amintiți, în atomică configurații de electroni s-ar putea scrie 2s22p4 în loc de 1s22s22p4 pentru oxigen; am fost ignorarea de bază. Când am desenat structuri Lewis, am dat oxigen șase electroni, în loc de opt; am ignorat miezul.
în contextul MO, să presupunem că avem electroni 2S. Asta înseamnă că fiecare atom are doi electroni 1s proprii, pentru un total de patru. Când cei patru electroni sunt umplute în MO diagrama de jos în sus, se va ocupa atât de lipire σ1s și antibonding σ1s*., Efectul ambelor combinații fiind ocupate este de a anula legătura; aceste două perechi de electroni rămân non-legare. Așa că le putem ignora și nu ne lipsește nimic.
orbitalii 2s nu sunt singurii din a doua coajă. Există, de asemenea, orbite 2P. Amintiți-vă, există câteva moduri foarte diferite în care orbitalii p se pot combina între ei, în funcție de axa pe care se află. Dacă nu se află paralele între ele-adică dacă sunt perpendiculare între ele, cum ar fi un px și un py-atunci nu pot interacționa deloc unul cu celălalt., Pz pe un atom ar putea interacționa cu pz pe celălalt atom, cu toate acestea, deoarece acestea sunt paralele între ele.de obicei, definim axa z ca fiind situată de-a lungul liniei dintre cei doi atomi pe care îi privim. Două orbitalii pz-ar afla de-a lungul axa, fiecare cu un lob de extindere în spațiul dintre atomi, și fiecare cu un alt lob extinderea departe, în cealaltă direcție.
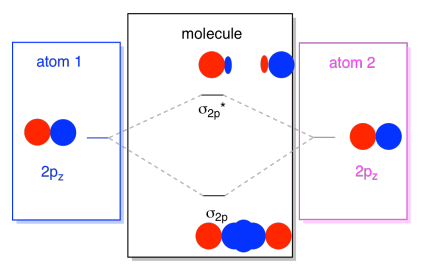
rezultat combinații sunt numite σ pentru că ei mint de-a lungul axei dintre atomi (asta e exact ceea ce σ înseamnă, în termeni de lipire)., Există o combinație σ, dacă lobii care se suprapun sunt în fază unul cu celălalt, și σ* combinație, dacă acei lobi sunt în afara fazei unul cu celălalt. Deoarece aceste noi orbite apar din orbitele atomice 2P, le numim σ2p și σ2p*.există, de asemenea, acele orbite p care nu se află de-a lungul axei legăturii sau a axei dintre cei doi atomi. Orbitalii px sunt perpendiculari pe orbitalii pz pe care tocmai i-am privit și, prin urmare, perpendiculari pe axa dintre legături. Cu toate acestea, ele sunt încă paralele între ele și pot forma în continuare combinații., Aceste două orbitale ar forma o combinație în fază și o combinație în afara fazei.
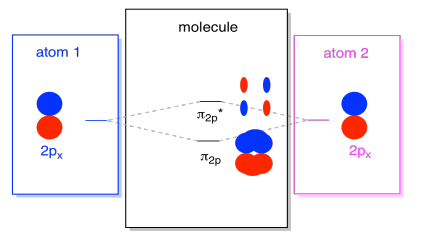
Rețineți că energic separare între aceste două combinații este un pic mai mic ca diferența dintre σ2p și σ2p* niveluri. Diferența este legată de gradul de suprapunere între orbitalii atomici. Orbitalii de pe axă se proiectează puternic în același spațiu; se suprapun foarte mult și interacționează puternic. Orbitalii din afara axei se periază unul împotriva celuilalt, interacționând mai puțin puternic și ducând la schimbări energetice mai mici., Diferența dintre n2p orbitale și n2p* orbital este, prin urmare, mult mai mică decât cea între σ2p și σ2p* orbitali.
există de fapt două dintre acele orbite p în afara axei. În plus față de setul px, am avea un set py. Dacă setul px se află în planul ecranului, setul py are unul orbital lipit în față și unul ascuns în spate. Cu toate acestea, combinațiile dintre cei doi orbitali py sunt exact aceleași cu ceea ce am văzut între cei doi orbitali px. Ele sunt doar rotite într-un plan perpendicular în raport cu combinațiile px.,
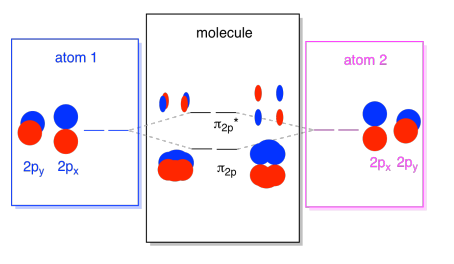
putem pune toate aceste orbitale bazate pe 2P împreună într-o singură diagramă. Începe să devină puțin mai aglomerat, dar această diagramă este doar o combinație a pieselor pe care le-am văzut deja. Rețineți că orbitalii atomici px, py și pz încep cu aceeași energie (le-am stivuit aici, astfel încât să puteți vedea în continuare corelația dintre orbitalii atomici și moleculari). Asta înseamnă că n2p & n2p* orbitali va fi „imbricate” între σ2p & σ2p* orbitali.,
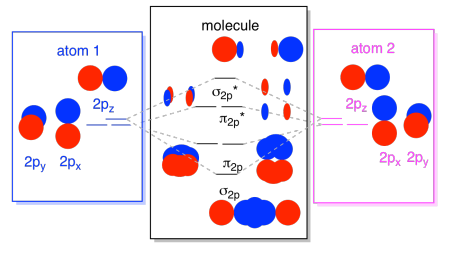
În cele din urmă, ținând cont de faptul că orbitalii 2p sunt mai mari în energie decât orbitalii 2S, putem combina aceste imagini într-o singură diagramă. Din nou, am văzut aceste piese individuale înainte; doar le asamblăm acum.
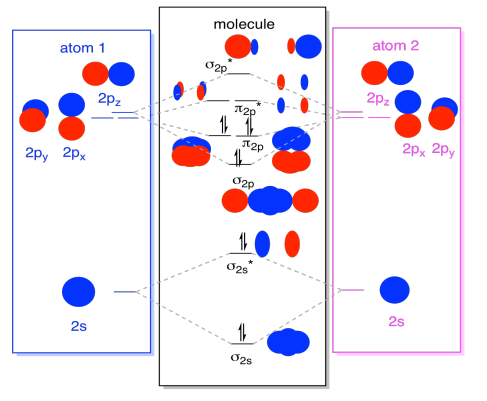
în timp ce suntem la ea, putem adăuga în electroni. Cum? Este doar numărul total de electroni de valență. De exemplu, am folosit N2., Fiecare azot are cinci electroni de valență, pentru un total de zece, așa că tocmai am completat zece electroni, începând de la baza diagramei nivelului energiei orbitale moleculare. Dacă aceasta ar fi o altă moleculă, cum ar fi F2 sau O2, am construi diagrama generală într-un mod similar, dar am folosi doar un număr diferit de electroni.imaginea orbitală pe care am descris-o mai sus este într-adevăr doar o imagine potențială a structurii electronice a dinitrogenului (și a oricărui alt grup principal sau bloc P diatomic)., Nu vom obține o imagine reală a structurii dinitrogenului până când nu vom popula aceste niveluri potențiale cu electroni.doar nivelurile de energie cu electroni au un efect asupra energiei (și comportamentului) moleculei.cu alte cuvinte, energia electronilor determină comportamentul moleculei. Celelalte niveluri de energie sunt doar posibilități care rămân neîmplinite.
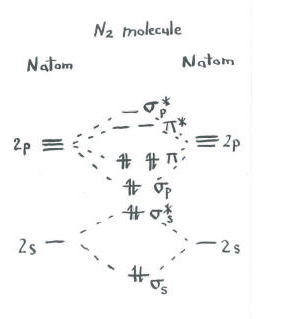
gândiți-vă la imaginea de dinitrogen.fiecare azot are cinci electroni de valență.
orbitalii rămași (S p* antibonding și fiecare dintre nivelurile p * antibonding) sunt neocupate. Acestea sunt niveluri imaginare care nu joacă un rol în determinarea energiei dinitrogenului. Într-un calcul orbital molecular real, electronii din aceste niveluri ar contribui la energia globală a moleculei.,obținem informații suplimentare din această imagine. De exemplu, putem vedea ordinea de obligațiuni în dinitrogen.ordinea legăturilor este doar numărul de legături dintre o pereche de atomi.
în dinitrogen, s s lipirea s s* nivelurile antibonding anula reciproc. O pereche este mai mică în energie decât a fost în atom, dar cealaltă este mai mare., Nu există o scădere netă a energiei. Acești electroni nu contribuie la o legătură azot-azot. Acestea sunt perechi de electroni care nu leagă.cu toate acestea, cei șase electroni din legarea S p și nivelurile de legare p reprezintă o scădere a energiei din nivelurile de energie din atomii liberi de azot. Aceste trei perechi de electroni cu energie redusă indică trei legături între atomii de azot.amintiți-vă, am făcut câteva scurtături în această imagine, iar un calcul orbital molecular real ar putea da rezultate ușor diferite., Cu toate acestea, ar dezvălui încă o ordine de legătură de trei, precum și două perechi de electroni care nu leagă.în plus, uneori imaginile orbitale moleculare sunt prezentate în moduri diferite. O diagramă de interacțiune orbitală moleculară arată cum orbitalii atomici sau moleculari se combină pentru a crea orbitali noi. Uneori, s-ar putea să ne intereseze doar nivelurile de energie orbitală moleculară în sine, și nu de unde provin. O diagramă a nivelului de energie orbitală moleculară arată doar nivelurile de energie din moleculă., Frecvent, dar nu întotdeauna, diagramele nivelului de energie sunt prezentate fără imagini ale orbitalilor, pentru a concentra atenția asupra nivelurilor de energie, care într-un mod fundamental sunt cea mai importantă parte a imaginii. În plus, deoarece numai nivelurile de energie ocupate contribuie efectiv la energia moleculei, uneori orbitalii neocupați cu energie superioară sunt lăsați în afara imaginii.foarte des, rezultatele calculelor orbitale moleculare întăresc ceea ce am prezice din structurile Lewis., Dacă desenați o structură Lewis De dinitrogen, veți prezice, de asemenea, o legătură triplă azot-azot. Avantajul principal al teoriei orbitale moleculare este că permite predicția cantitativă a energiei atunci când facem un calcul real pe un computer. În plus, este important să ne dăm seama că nu există niciun motiv real pentru regula octetului dacă nu luăm în considerare mecanica cuantică. Structurile Lewis se bazează pe o observație empirică că electronii formează perechi și octeți, fără a încerca să explice de ce., Teoria orbitală moleculară ia unele relații fundamentale din fizică și le aplică moleculelor foarte complicate, cu un succes foarte bun. Doar cunoscând numărul de electroni din moleculă și știind aproximativ unde se află nucleele în structură, calculele orbitale moleculare oferă informații foarte utile despre energie. În plus, în cazuri mai complicate decât N2, aceste calcule pot corecta chiar și prima noastră presupunere despre geometria moleculară și unde sunt localizate legăturile.,
Exercise \(\PageIndex{2}\)
o diagramă orbitală moleculară pentru o moleculă diatomică (doi atomi) variază în numărul de electroni. Cum populezi electronii?
răspuns • * numărați electronii de valență pe moleculă. Acesta este numărul de electroni de valență pe fiecare atom, ajustat pentru orice sarcină pe moleculă. (de exemplu, C22-are 10 electroni de valență: 4 din fiecare carbon-adică 8-și încă doi pentru sarcina 2).
• umpleți mai întâi electronii în orbitalii cu cea mai mică energie.
* electroni pereche după toate orbitalii la același nivel de energie au un electron.,
exercițiu \(\PageIndex{3}\)
construiți o diagramă orbitală moleculară calitativă pentru clor, Cl2. Comparați ordinea legăturii cu cea văzută în structura Lewis (amintiți-vă că un electron într-un orbital antibonding anulează stabilizarea datorită legării unui electron într-un orbital de legătură).
Răspuns 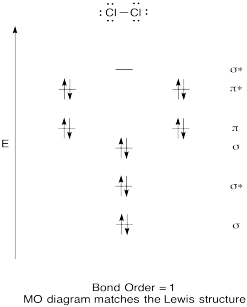
Exercițiu \(\PageIndex{4}\)
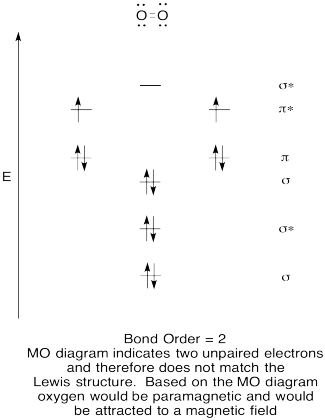
- Construi un calitativă molecular orbital diagrama de oxigen, O2.
- comparați ordinea obligațiunilor cu cea văzută în structura Lewis.,
- cum altfel se compară această imagine MO a oxigenului cu structura Lewis? Ce vă spun cele două structuri despre împerecherea electronilor?
- compușii care au toți electronii asociați sunt denumiți diamagnetici. Cei cu electroni nepereche sunt denumite paramagnetice. Materialele paramagnetice sunt atrase de un câmp magnetic, dar lucrurile diamagnetice nu sunt. Cum te-ai aștepta să se comporte oxigenul molecular?,
Răspunsul
Exercițiu \(\PageIndex{5}\)
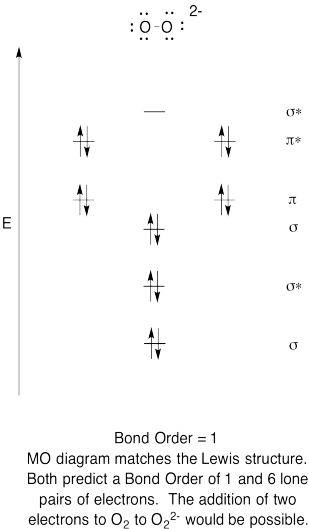
- Construi un calitativă molecular orbital diagrama de peroxid de anioni, O22-.
- comparați ordinea obligațiunilor cu cea văzută în structura Lewis.
- cum altfel se compară această imagine MO a oxigenului cu structura Lewis? Ce vă spun cele două structuri despre împerecherea electronilor?,
- Pe baza imaginilor orbitale moleculare, cât de ușor credeți că dioxigenul ar putea fi redus la peroxid (prin adăugarea a doi electroni)?
Răspunsul
Exercițiu \(\PageIndex{6}\)
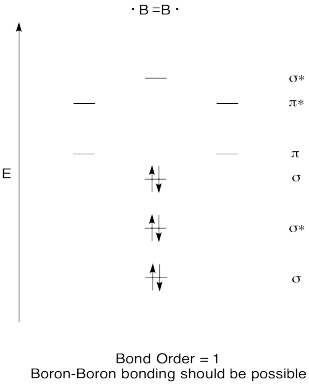
Construi un calitativă molecular orbital diagrama pentru diboron, B2. Credeți că legăturile bor-bor s-ar putea forma cu ușurință, pe baza acestei imagini?,
Răspuns
Exercițiu \(\PageIndex{7}\)
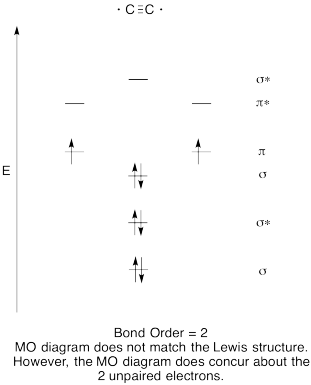
- Construi un calitativă molecular orbital diagrama pentru dicarbon, C2.
- comparați ordinea obligațiunilor cu cea văzută în structura Lewis.
- cum altfel se compară această imagine MO a oxigenului cu structura Lewis? Ce vă spun cele două structuri despre împerecherea electronilor?,
Răspunsul
Exercițiu \(\PageIndex{8}\)
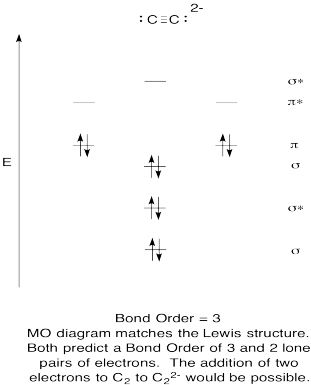
- Construi un calitativă molecular orbital diagrama pentru acetylide anioni, C22-.
- comparați ordinea obligațiunilor cu cea văzută în structura Lewis.
- cum altfel se compară această imagine MO a oxigenului cu structura Lewis? Ce vă spun cele două structuri despre împerecherea electronilor?,
- pe Baza molecular orbital imagini, cât de ușor crezi că dicarbon ar putea fi redus la acetylide (prin adaos de doi electroni)?
Răspunsul
Exercițiu \(\PageIndex{9}\)
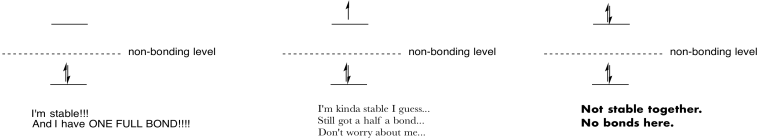
Face desene și note pentru a rezuma efectul de popularea antibonding orbitali.
Răspuns
Atribuire
Chris P Schaller, Ph. d.,, (Colegiul Sfântului Benedict / Universitatea Sfântul Ioan)