Introducere
concentrația este măsura cantității de substanță dată amestecată cu o altă substanță. Se spune că soluțiile sunt fie diluate, fie concentrate. Când spunem că oțetul este \(5\%\) acid acetic în apă, dăm concentrația. Dacă am spune că amestecul a fost\ (10\%\) acid acetic, acest lucru ar fi mai concentrat decât soluția de oțet.,
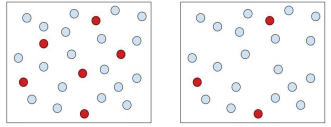
O soluție concentrată este una în care există o cantitate mare de substanță dizolvată într-o anumită cantitate de solvent., O soluție diluată este una în care există o cantitate mică de solut într-o anumită cantitate de solvent. O soluție diluată este o soluție concentrată care a fost, în esență, udată. Gândiți-vă la recipientele cu suc congelat pe care le cumpărați în magazinul alimentar. Pentru a face suc, trebuie să amestecați concentratul de suc congelat din interiorul acestor recipiente cu trei sau patru ori dimensiunea recipientului plin cu apă. Prin urmare, diluați sucul concentrat. În ceea ce privește solute și solvent, soluția concentrată are o mulțime de solute față de soluția diluată care ar avea o cantitate mai mică de solute.,termenii ” concentrat „și” diluat ” oferă metode calitative de descriere a concentrației. Deși observațiile calitative sunt necesare și își au locul în fiecare parte a științei, inclusiv în chimie, am văzut de-a lungul studiului nostru despre știință că există o nevoie certă de măsurători cantitative în știință. Acest lucru este valabil mai ales în chimia soluției. În această secțiune, vom explora câteva metode cantitative de exprimare a concentrației soluției.