badanie kinetyki umożliwia naukowcom określenie zależności między zmianami warunków a szybkością danej reakcji chemicznej. Jednym z najważniejszych czynników, które wpływają na szybkość reakcji jest reaktywność substancji chemicznych zaangażowanych w tej konkretnej reakcji; Ponadto, istnieje kilka zmiennych, które mogą również wpływać na szybkość reakcji (stężenie, temperatura, katalizator, itp.).
jedna z takich zmiennych jest uważana za kolizję.,
każda reakcja chemiczna wymaga zderzeń pomiędzy cząstkami reagującymi (atomami i / lub cząsteczkami). Z drugiej strony, nie wszystkie kolizje promują reakcję, która ma miejsce. Zamiast tego, jeśli zderzające się cząstki nie mają wystarczającej energii kinetycznej lub właściwej orientacji w przestrzeni, reakcja nie nastąpi.
ale co oznacza „wystarczająca energia” lub „właściwa orientacja”? Aby lepiej zrozumieć wspomniane wcześniej pojęcia, artykuł dostarczy kilka ogólnych definicji wraz z odpowiednimi przykładami i przykładowymi problemami.,
naszym głównym celem jest zdefiniowanie pojęcia energii aktywacyjnej i wyjaśnienie, dlaczego niektóre kolizje nie powodują reakcji.
w związku z tym w tym artykule skupimy się przede wszystkim na koncepcji kolizji reaktywnej. Wraz z tym krótko omówimy niektóre scenariusze dotyczące niereaktywnych kolizji. Ponieważ zderzenia są związane z dwiema głównymi cechami, energią i orientacją przestrzenną, omówimy również te terminy.,
teoria kolizji
jak już wspomnieliśmy powyżej, zderzenia między dwiema lub więcej cząsteczkami muszą nastąpić, aby miała miejsce reakcja chemiczna. Ale kolizja nie wystarczy, aby reagenty zostały przekształcone w produkty. Cząsteczki muszą mieć wystarczającą ilość energii i muszą zderzać się z prawidłową orientacją przestrzenną.
jak być może już wiesz, istnieją różne rodzaje reakcji, w tym synteza, rozkład, przemieszczenie i spalanie., Biorąc pod uwagę fakt, że teoria kolizji skupia się na reakcjach obejmujących zderzenia między dwoma gatunkami, nie musisz się martwić o reakcje rozkładu, ponieważ w takich przypadkach pojedynczy związek rozpada się i nie ma potrzeby rozważania zderzeń lub orientacji cząstek w przestrzeni.
w przypadku reakcji z udziałem dwóch gatunków, zderzenia między cząsteczkami są kluczowe dla przebiegu reakcji; ale tylko zderzenia cząsteczek o wystarczającej energii kinetycznej i odpowiedniej orientacji przestrzennej mogą spowodować reakcję., Tak więc energia jest potrzebna do zerwania wiązań w reagujących cząsteczkach, podczas gdy orientacja cząsteczek w przestrzeni odgrywa ważną rolę w ułożeniu odpowiednich atomów ze sobą, aby zreformować zerwane wiązania we właściwy sposób.
gdy oba kryteria są spełnione, kolizja jest uważana za kolizję udaną, skuteczną lub reaktywną.
biorąc pod uwagę znaczenie dwóch czynników wymienionych powyżej (energii i orientacji), powinniśmy kontynuować dalsze wyjaśnienie terminów i pojęć, aby lepiej zrozumieć zasady teorii zderzeń.,
energia aktywacji
jak już wspomnieliśmy wcześniej, cząstki muszą zderzać się z wystarczającą ilością energii, aby doszło do reakcji. Ta minimalna energia wymagana do przebiegu reakcji jest zdefiniowana jako energia aktywacji.,
jak wiadomo, istnieją dwa rodzaje reakcji dotyczących uwalniania energii lub absorpcji, które są następujące:
- reakcja endotermiczna – energia jest absorbowana w reakcji (zwykle w postaci ciepła)
- reakcja egzotermiczna – energia jest uwalniana w reakcji (zwykle w postaci ciepła)
na pierwszy rzut oka może się wydawać, że skoro energia jest uwalniana w reakcji egzotermicznej, nie powinno być potrzeby wprowadzania energii do reakcji.reakcja zachodzi. Wręcz przeciwnie, zarówno endotermiczne, jak i egzotermiczne reakcje chemiczne wymagają energii, aby rozpocząć.,
wydaje się to trochę dziwne, prawda? Dlaczego reakcja wymaga wkładu energii, jeśli energia jest w konsekwencji uwalniana?
rozważmy następujące przykłady reakcji egzotermicznych zachodzących w naszym codziennym życiu.

przykład #1 – spalanie świecy
spalanie świecy uwalnia energię w postaci ciepła, dlatego reakcja zachodząca podczas procesu jest egzotermiczna. Oczywiście musisz zapalić świecę za pomocą zapałki lub zapalniczki., Oznacza to, że musisz wprowadzić trochę energii, aby świeca się zapaliła. Następnie reakcja ma wystarczającą energię, aby przejść do kolejnych kroków, a świeca nadal pali energię.
jednak świeca nigdy sama nie stanie w płomieniach, prawda?
przykład #2 – Oświetlenie zapałki

typowa Głowica zapałki składa się z siarki zmieszanej z różnymi środkami utleniającymi. Aby zapalić zapałkę, należy pocierać główkę zapałki o specjalną stronę pudełka zapałek., Podczas tego procesu zachodzi reakcja i uwalnia energię w postaci światła i ciepła. Tak więc reakcja jest uważana za egzotermiczną. Chociaż nadal musisz wprowadzić trochę energii, aby zapałka zaczęła się palić. Energia ta jest zdefiniowana za pomocą terminu ” energia aktywacji.”Podobnie jak w poprzednim przykładzie, tak długo, jak zapewnisz wystarczającą ilość energii, aby zapałka świeciła, będzie nadal palić i uwalniać ciepło samodzielnie.
Wykres energii aktywacji przedstawia zmiany energii zachodzące podczas reakcji chemicznej.,
aby wykreślić wykres energii aktywacji, należy wziąć pod uwagę dwie zmienne:
- liczba zderzeń pomiędzy różnymi cząsteczkami
- energia kinetyczna zderzających się cząsteczek
pierwsza zmienna jest dość łatwa do zrozumienia, ponieważ ma bezpośrednie znaczenie – określa liczbę zderzeń między cząsteczkami dwóch gatunków na sekundę.
druga zmienna to energia kinetyczna zderzających się cząsteczek, którą można zdefiniować jako energię ruchu cząsteczek.
- reakcja endotermiczna – energia jest absorbowana., Energia reagentów jest niższa niż energia produktów.
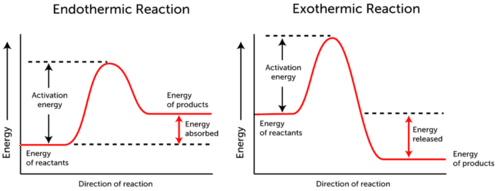
- egzotermiczna reakcja – energia jest uwalniana. Energia reagentów jest czymś więcej niż energią produktów.
jak widać na dwóch wykresach powyżej, energia aktywacji zarówno dla reakcji endotermicznych, jak i egzotermicznych jest taka sama.,
ponieważ reakcja endotermiczna nie może wytworzyć tyle energii, ile potrzebuje do wystąpienia reakcji, energia jest pochłaniana; dlatego energia produktów jest wyższa niż energia reagentów.
przeciwnie, reakcje egzotermiczne wytwarzają więcej energii niż wykorzystują jako energię aktywacyjną. W rezultacie energia jest uwalniana, a produkty mają mniejszą energię niż reagenty.,
jako wniosek można stwierdzić, że nawet jeśli reagujące cząsteczki szybko zderzają się ze sobą, istotne jest, aby cząsteczki miały wystarczającą energię do wystąpienia reakcji.
Orientacja przestrzenna
zgodnie z teorią zderzeń nie wszystkie zderzenia są udane, nawet jeśli reagujące cząsteczki mają wystarczającą energię aktywacji. Cząsteczki muszą również zderzać się we właściwy sposób.
tak więc drugim aspektem wpływającym na zderzenia reaktywne jest orientacja przestrzenna(orientacja cząsteczek w przestrzeni).,
co oznacza „właściwa” orientacja cząsteczek w reakcji?
gdy dwie cząsteczki zderzają się, obie cząsteczki muszą być usytuowane w taki sposób, aby łatwo im było reagować. Aby w pełni zrozumieć koncepcję, ważne jest, aby podkreślić mechanizm reakcji.
rozważmy reakcję między propylenem (lub propenem) i bromkiem wodoru jako przykład:

Jak widać powyżej, reakcja przebiega w 2 kroki.,
Krok 1: podwójne wiązanie jest przerwane
Krok 2: dołączony jest brom
w tej reakcji orientacje molekularne HBr i C3H6 odgrywają ważną rolę, ponieważ jeden z nich był położony w inny sposób, nie byłoby możliwe, aby atom H zbliżył się do cząsteczki propylenu.
To prawda dla każdej reakcji. Każda cząsteczka musi mieć odpowiednią orientację w przestrzeni, aby reakcja miała miejsce. Prawidłowa orientacja zapewnia, że cząsteczki są usytuowane w taki sposób, że stosunkowo łatwo je zderzać i reagować.,
możemy wnioskować, że korzystna orientacja reagujących cząsteczek jest tak samo istotna, jak wystarczająca energia aktywacji.
podsumowanie
terminy i pojęcia zdefiniowane w artykule są podsumowane w poniższej tabeli:
| teoria zderzeń | wyjaśnia, w jaki sposób cząstki powinny wchodzić w interakcje lub ze sobą, aby wywołać reakcję., Zgodnie z teorią zderzeń, aby reakcja chemiczna miała miejsce, muszą być spełnione dwa kryteria: cząsteczki muszą zderzać się z wystarczającą energią aktywacji, aby zerwać i ponownie utworzyć istniejące wiązania; cząsteczki muszą zderzać się z korzystną orientacją przestrzenną. |
| kolizja udana (zwana również kolizją efektywną lub reaktywną) | kolizja cząsteczek o wystarczającej energii aktywacji i właściwej orientacji w przestrzeni, która skutkuje reakcją chemiczną., |
| energia aktywacji | minimalna energia wymagana do wystąpienia reakcji. W przypadku reakcji endotermicznych, jak i egzotermicznych, potrzebna jest energia. |
| reakcja endotermiczna | Energia (ciepło) jest pochłaniana; energia reagentów jest niższa niż energia produktów; nie może wytworzyć tyle energii, ile zużywa podczas reakcji., |
| reakcja egzotermiczna | energia (ciepło) jest uwalniana; energia reagentów jest wyższa niż energia produktów; może wytworzyć więcej energii niż zużywa podczas reakcji. |
| orientacja molekularna | Orientacja przestrzenna cząsteczek., |
Three different scenarios are represented in the picture attached below:
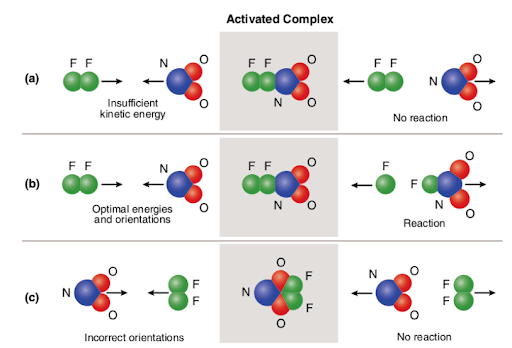
The picture summarizes the concept of collision theory utilizing two reactant molecules (fluorine (F2) and molecular nitrogen dioxide (NO2)) and three different cases to form nitrogen oxyfluoride.,
w przypadku (a), reagujące cząsteczki mają właściwą orientację przestrzenną, ale nie mają wystarczającej energii aktywacji; dlatego reakcja nie zachodzi ze względu na fakt, że nie ma wystarczającej energii do zerwania wiązań. Tak więc zderzenie między dwoma cząsteczkami jest uważane za niereaktywne.
w przypadku (b), reagujące cząsteczki mają zarówno wystarczającą energię aktywacji, jak i właściwą orientację w przestrzeni. Ze względu na optymalną charakterystykę cząsteczek, reakcja przebiega i powstaje oksyfluorek azotu., Tak więc zderzenie między dwoma cząsteczkami jest uważane za reaktywne.
w przypadku (c), reagujące cząsteczki mają wystarczającą energię aktywacji, ale nie są prawidłowo usytuowane w przestrzeni; dlatego reakcja nie zachodzi, ponieważ nie jest możliwe, aby cząsteczki docierały do siebie w sposób, który łamie wiązania. Tak więc, podobnie jak w pierwszym przypadku, zderzenie między dwoma cząsteczkami jest uważane za niereaktywne.