Richard Baxter i Jim Britton
jak stal koroduje w wodzie?
aby zrozumieć ochronę katodową, musisz najpierw zrozumieć, w jaki sposób powstaje korozja. Aby doszło do korozji, muszą być obecne trzy rzeczy:
1. Dwa odmienne metale
2. Elektrolit (woda z dowolnym rodzajem soli lub rozpuszczonych w niej soli)
3., Ścieżka metalowa (przewodząca) między różnymi metalami
dwa różne metale mogą być zupełnie różnymi stopami-takimi jak stal i aluminium – ale są bardziej prawdopodobne, że będą mikroskopijnymi lub makroskopowymi różnicami metalurgicznymi na powierzchni pojedynczego kawałka stali. W tym przypadku rozważymy swobodnie korodującą stal, która jest niejednolita.
Jeśli powyższe warunki istnieją, następująca reakcja zachodzi w miejscach bardziej aktywnych: (dwa jony żelaza plus cztery wolne elektrony).,
2FE => 2FE++ + 4e-
wolne elektrony przemieszczają się przez metalową ścieżkę do mniej aktywnych miejsc, gdzie zachodzi następująca reakcja: (Gaz tlenowy jest przekształcany w jon tlenu-przez połączenie z czterema swobodnymi elektronami – które łączą się z wodą tworząc jony hydroksylowe).
O2 + 4e- + 2h20 => 4 OH-
Rekombinacje tych jonów na powierzchni aktywnej wywołują następującą reakcję, która daje produkt korozji żelaza wodorotlenek żelaza: (żelazo łączy się z tlenem i wodą, tworząc wodorotlenek żelaza).,
2FE + O2 + 2H2O => 2FE (OH)2
reakcja ta jest częściej opisywana jako 'przepływ prądu przez wodę z anody (bardziej aktywne miejsce) do katody (mniej aktywne miejsce).”
w jaki sposób Ochrona katodowa zatrzymuje korozję?
Ochrona katodowa zapobiega korozji, przekształcając wszystkie miejsca anodowe (aktywne) na powierzchni metalu w miejsca katodowe (pasywne), dostarczając prąd elektryczny (lub wolne elektrony) z alternatywnego źródła.
zwykle przyjmuje postać anod galwanicznych, które są bardziej aktywne niż stal., Praktyka ta jest również określana jako system ofiarny, ponieważ anody galwaniczne poświęcają się, aby chronić stal konstrukcyjną lub rurociąg przed korozją.
w przypadku anod aluminiowych reakcja na powierzchni aluminium wynosi: (cztery jony aluminium plus dwanaście wolnych elektronów)
4Al => 4AL+++ + 12 e –
i na powierzchni stali: (Gaz tlenowy przekształcony w jony tlenu, które łączą się z wodą, tworząc jony hydroksylowe).,
3O2 + 12E- + 6H20 => 12oh-
dopóki prąd (wolne elektrony) dotrze na katodę (stal) szybciej niż dotrze tlen, nie dojdzie do korozji.,
podstawowe uwagi przy projektowaniu układów anodowych
prąd elektryczny rozładowania anody jest kontrolowany przez prawo Ohm, które jest:
I=E/R
i= przepływ prądu w amperach
E= różnica potencjałów między anodą a katodą w woltach
R= całkowita rezystancja obwodu w omach
początkowo prąd będzie wysoki, ponieważ różnica potencjałów między anodą a katodą jest i katody są wysokie, ale gdy różnica potencjałów maleje z powodu wpływu przepływu prądu na katodę, prąd stopniowo maleje z powodu polaryzacji katody., Rezystancja obwodu obejmuje zarówno ścieżkę wodną, jak i ścieżkę metalową, która obejmuje dowolny kabel w obwodzie. Dominującą wartością jest tutaj odporność anody na wodę morską.
w większości zastosowań odporność metalu jest tak mała w porównaniu do wodoodporności, że można ją zignorować (chociaż nie dotyczy to sanek lub długich rurociągów chronionych z obu końców). Ogólnie rzecz biorąc, długie, cienkie anody mają mniejszą rezystancję niż krótkie, grube anody. Będą rozładowywać więcej prądu, ale nie potrwa tak długo.,
dlatego projektant ochrony katodowej musi rozmiar anod tak, aby miały odpowiedni kształt i powierzchnię, aby rozładować prąd wystarczający do ochrony konstrukcji i wystarczająco dużo masy, aby trwać pożądaną żywotność podczas rozładowywania tego prądu.
zgodnie z ogólną zasadą:
długość anody określa, ile prądu może wytworzyć anoda, a co za tym idzie, ile stóp kwadratowych stali można zabezpieczyć. Przekrój (waga) określa, jak długo anoda może utrzymać ten poziom ochrony.,
Impressed-current cathodic protection systems (systemy anodowe ICCP)
Impressed-current cathodic protection systems (systemy anodowe ICCP)
ze względu na wysokie prądy występujące w wielu systemach wody morskiej, nie jest rzadkością stosowanie systemów impressed-current, które wykorzystują anody typu (anody ICCP), które nie są łatwo rozpuszczalne w jonach metalicznych. Powoduje to reakcję alternatywną: utlenianie rozpuszczonych jonów chlorkowych.
2CL – => Cl2 + 2E-
zasilanie jest dostarczane przez zewnętrzny zasilacz PRĄDU STAŁEGO.,

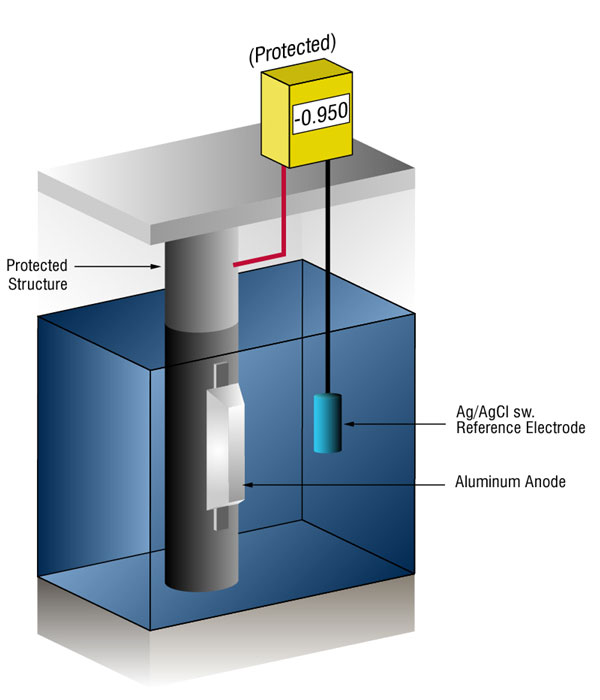
skąd wiemy, kiedy mamy wystarczającą ochronę katodową?
możemy sprawdzić, czy jest wystarczająco dużo prądu, mierząc potencjał stali w stosunku do Standardowej elektrody referencyjnej, Zwykle srebrno-srebrno-chlorkowej (Ag/AgCl sw.), ale czasami cynk (SZW.).
przepływ prądu na dowolny metal przesunie swój normalny potencjał w kierunku ujemnym. Historia pokazała, że jeśli stal otrzymuje wystarczająco dużo prądu, aby przesunąć potencjał do ( – ) 0.800 V vs., silver / silver chloride (Ag / AgCl), the corrosion is essentially stopped.
 |
 |