cele uczenia się
- aby uzyskać zrozumienie teorii zderzeń.
- aby zrozumieć cztery główne czynniki, które wpływają na szybkość reakcji.
Kinetyka reakcji jest badaniem szybkości reakcji chemicznych, a szybkości reakcji mogą się znacznie różnić w szerokim zakresie skal czasowych. Niektóre reakcje mogą przebiegać w wybuchowych szybkościach, takich jak detonacja fajerwerków (rysunek 17.,1 „fajerwerki w nocy nad rzeką”), podczas gdy inne mogą wystąpić w powolnym tempie przez wiele lat, takich jak rdzewienie drutu kolczastego wystawionego na działanie elementów (rysunek 17.2 „zardzewiały Drut kolczasty”).
rysunek 17.1. Fajerwerki w nocy nad rzeką

reakcja chemiczna w fajerwerkach odbywa się w tempie wybuchowym.
rysunek 17.2. Zardzewiały Drut kolczasty

rdzewienie drutu kolczastego występuje przez wiele lat.,
teoria kolizji
aby zrozumieć kinetykę reakcji chemicznych oraz czynniki wpływające na kinetykę, powinniśmy najpierw zbadać, co dzieje się podczas reakcji na poziomie molekularnym. Zgodnie z teorią kolizji reaktywności, reakcje zachodzą, gdy reagujące cząsteczki „skutecznie zderzają się.”Aby doszło do” efektywnej kolizji”, reagujące cząsteczki muszą być prawidłowo zorientowane w przestrzeni, aby ułatwić łamanie i tworzenie wiązań oraz przegrupowanie atomów, które prowadzą do powstawania cząsteczek produktu (Rysunek 17.3 „wizualizacje zderzeń”).
rysunek 17.3., Wizualizacje kolizji
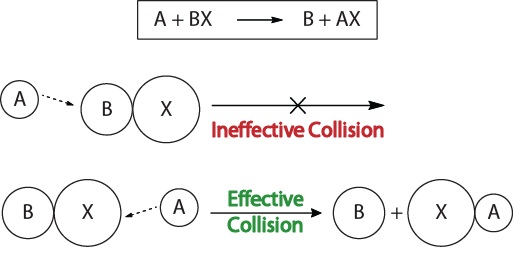
ta wizualizacja pokazuje nieefektywną i skuteczną kolizję opartą na orientacji molekularnej.
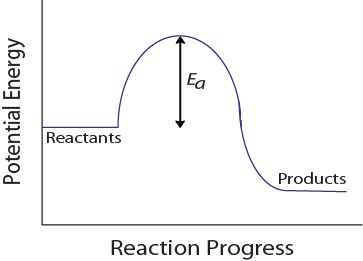
podczas zderzenia molekularnego cząsteczki muszą również posiadać minimalną ilość energii kinetycznej, aby doszło do zderzenia skutecznego. Energia ta zmienia się dla każdej reakcji i jest znana jako energia aktywacji (EA) (rysunek 17.4 „energia potencjalna i energia aktywacji”)., Szybkość reakcji zależy zatem od energii aktywacji; wyższa energia aktywacji oznacza, że mniej cząsteczek będzie miało wystarczającą energię, aby poddać się efektywnemu zderzeniu.
rysunek 17.4. Energia potencjalna i energia aktywacji
czynniki, które wpływają na szybkość reakcji
istnieją cztery główne czynniki, które mogą wpływać na szybkość reakcji chemicznej:
1. Stężenie reagentu., Zwiększenie stężenia jednego lub więcej reagentów często zwiększa szybkość reakcji. Dzieje się tak, ponieważ wyższe stężenie reagenta doprowadzi do większej liczby kolizji tego reagenta w określonym okresie czasu.
2. Stan fizyczny reagentów i powierzchni. Jeśli cząsteczki reagentów istnieją w różnych fazach, jak w mieszaninie heterogenicznej, szybkość reakcji będzie ograniczona przez powierzchnię faz, które są w kontakcie., Na przykład, jeśli stały reagent metalowy i reagent gazowy są mieszane, tylko cząsteczki obecne na powierzchni metalu są w stanie zderzyć się z cząsteczkami gazu. Dlatego zwiększenie powierzchni metalu przez Walenie go na płasko lub cięcie na wiele kawałków zwiększy szybkość reakcji.
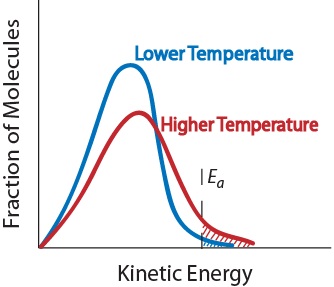
3. Temperatura. Wzrost temperatury zazwyczaj zwiększa szybkość reakcji. Wzrost temperatury podniesie średnią energię kinetyczną reagujących cząsteczek., Dlatego większa część cząsteczek będzie miała minimalną energię niezbędną do skutecznego zderzenia (rysunek. 17,5 „temperatura i szybkość reakcji”).
rysunek. 17.5 temperatura i szybkość reakcji
4. Obecność katalizatora. Katalizator jest substancją, która przyspiesza reakcję uczestnicząc w niej bez konsumowania. Katalizatory zapewniają alternatywną ścieżkę reakcji w celu uzyskania produktów., Są one krytyczne dla wielu reakcji biochemicznych. Zostaną one omówione dalej w sekcji ” Kataliza.”
kluczowe reakcje
- zachodzą, gdy dwie reagujące cząsteczki skutecznie zderzają się ze sobą, z których każda ma minimalną energię i prawidłową orientację.
- stężenie reagentów, stan fizyczny reagentów i powierzchnia, temperatura i obecność katalizatora są cztery główne czynniki, które wpływają na szybkość reakcji.