10.2 Brønsted-Lowry definicja kwasów i zasad
cele uczenia się
- Rozpoznaj związek jako kwas Brønsted-Lowry lub zasadę Brønsted-Lowry.
- ilustruje proces transferu protonu, który definiuje reakcję kwasowo-zasadową Brønsteda-Lowry ' ego.
amoniak (NH3) zwiększa stężenie jonów wodorotlenkowych w roztworze wodnym poprzez reakcję z wodą, a nie bezpośrednie uwalnianie jonów wodorotlenkowych., W rzeczywistości definicje Arrheniusa kwasu i zasady koncentrują się na jonach wodorowych i jonach wodorotlenkowych. Czy istnieją bardziej fundamentalne definicje kwasów i zasad?
w 1923 roku Duński naukowiec Johannes Brønsted i angielski naukowiec Thomas Lowry niezależnie zaproponowali nowe definicje kwasów i zasad. Zamiast brać pod uwagę zarówno jony wodorowe, jak i wodorotlenkowe, skupiali się tylko na Jonie wodorowym. Związek brønsted-Lowry acidA dostarczający w reakcji jon wodorowy (H+); donor protonów. jest związkiem, który dostarcza jon wodorowy w reakcji., Związek bazowy Brønsteda-Lowry ' ego, który w reakcji przyjmuje jon wodorowy (H+); akceptor protonów. natomiast jest związkiem przyjmującym w reakcji jon wodorowy. Dlatego też definicja kwasu i zasady Brønsteda-Lowry ' ego skupia się na ruchu jonów wodorowych w reakcji, a nie na wytwarzaniu jonów wodorowych i wodorotlenkowych w roztworze wodnym.
zastosujmy reakcję amoniaku w wodzie, aby zademonstrować definicje Brønsteda-Lowry ' ego kwasu i zasady., Cząsteczki amoniaku i wody są reaktantami, podczas gdy jon amonowy i Jon wodorotlenkowy są produktami:
NH3(AQ) + H2O(ℓ) → NH4+(aq) + OH−(AQ)
w tej reakcji doszło do tego, że oryginalna cząsteczka wody przekazała jon wodorowy oryginalnej cząsteczce amoniaku, która z kolei zaakceptowała jon wodorowy. Możemy to zilustrować w następujący sposób:
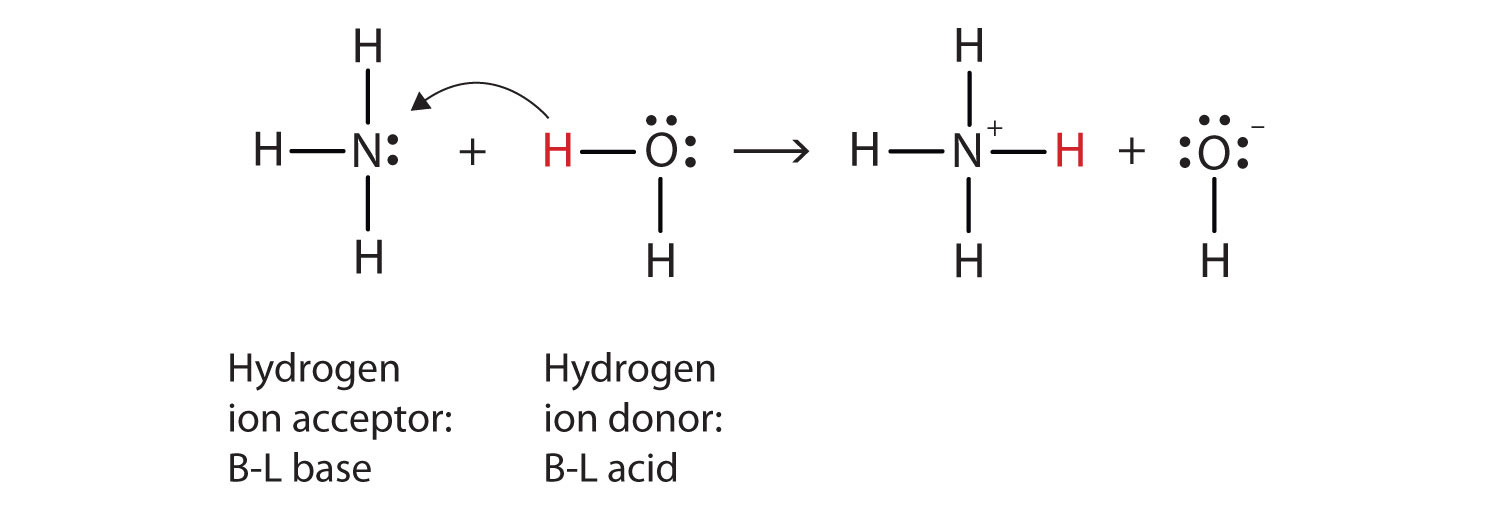
ponieważ cząsteczka wody przekazuje jon wodorowy amoniakowi, jest to kwas Brønsted-Lowry, podczas gdy cząsteczka amoniaku—która przyjmuje jon wodorowy—jest zasadą Brønsted-Lowry., Tak więc amoniak działa jako podstawa zarówno w sensie Arrheniusa, jak i Brønsteda-Lowry ' ego.
czy kwas Arrheniusa jak kwas solny jest jeszcze kwasem w sensie Brønsteda-Lowry ' ego? Tak, ale to wymaga od nas zrozumienia, co tak naprawdę dzieje się, gdy HCl rozpuszcza się w wodzie. Przypomnijmy, że atom wodoru jest pojedynczym protonem otoczonym pojedynczym elektronem. Aby wytworzyć jon wodorowy, usuwamy elektron, pozostawiając goły proton. Czy naprawdę mamy gołe protony unoszące się w roztworze wodnym? Nie, Nie mamy., Tak naprawdę jon H+ przyłącza się do H2O, tworząc H3O+, który nazywa się Jonem hydroniowym. W większości przypadków H + I H3O+ reprezentują ten sam gatunek, ale pisanie H3O+ zamiast H+ pokazuje, że rozumiemy, że w roztworze nie występują gołe protony. Protony te są raczej przyłączone do cząsteczek rozpuszczalnika.
Uwaga
proton w roztworze wodnym może być otoczony więcej niż jedną cząsteczką wody, co prowadzi do wzorów takich jak H5O2+ lub h9o4+, a nie H3O+. Prostsze jest jednak stosowanie H3O+.,
mając to na uwadze, jak definiujemy HCl jako kwas w sensie Brønsteda-Lowry ' ego? Zastanów się, co się dzieje, gdy HCl rozpuszcza się w H2O:
HCl + H2O(ℓ) → H3O+(AQ) + Cl−(AQ)
możemy przedstawić ten proces za pomocą diagramów kropek elektronowych Lewisa:
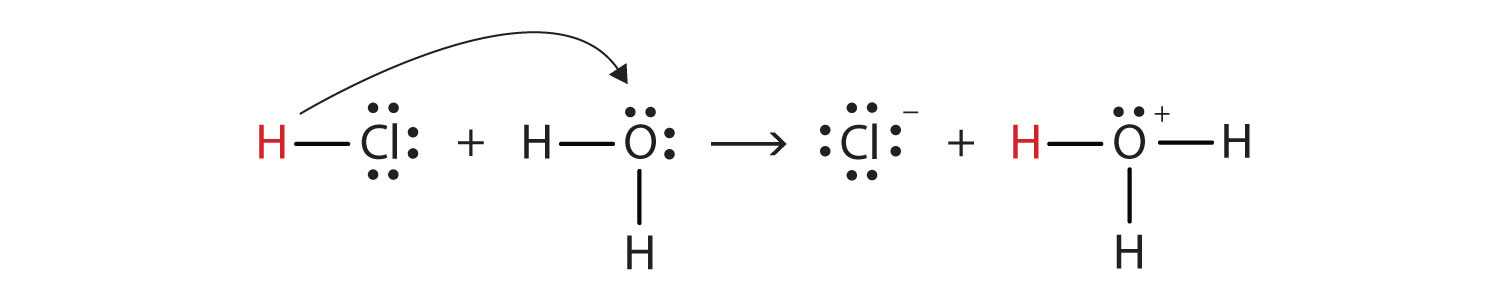
teraz widzimy, że Jon wodorowy jest przenoszony z cząsteczki HCl do cząsteczki H2O, aby wytworzyć jony chlorkowe i jony hydronium. Jako donor jonów wodorowych, HCl działa jako kwas Brønsted-Lowry; jako akceptor jonów wodorowych, H2O jest zasadą Brønsted-Lowry., Zatem HCl jest kwasem nie tylko w sensie Arrheniusa, ale także w sensie Brønsteda-Lowry ' ego. Ponadto, zgodnie z definicjami Brønsteda-Lowry ' ego, H2O jest podstawą w tworzeniu wodnego HCl. Tak więc definicja Brønsteda-Lowry ' ego kwasu i zasady klasyfikuje rozpuszczanie HCl w wodzie jako reakcję między kwasem a zasadą—chociaż definicja Arrheniusa nie oznaczałaby w tej sytuacji H2O jako zasady.
Uwaga
wszystkie kwasy i zasady Arrheniusa to również kwasy i zasady Brønsteda-Lowry ' ego. Jednak nie wszystkie kwasy i zasady Brønsted-Lowry ' ego to kwasy i zasady Arrheniusa.,
przykład 3
anilina (C6H5NH2) jest słabo rozpuszczalna w wodzie. Ma atom azotu, który może przyjąć jon wodorowy z cząsteczki wody, tak jak atom azotu w amoniaku. Napisz równanie chemiczne dla tej reakcji i zidentyfikuj kwas i zasadę Brønsteda-Lowry ' ego.
roztwór
C6H5NH2 i H2O są reaktantami. Kiedy C6H5NH2 przyjmuje proton z H2O, zyskuje dodatkowy ładunek h i dodatni i pozostawia jon OH., Reakcja jest następująca:
C6H5NH2 ( AQ)+H2O(ℓ) → C6H5NH3 + (AQ) + OH−(AQ)
ponieważ C6H5NH2 przyjmuje proton, jest to baza Brønsteda-Lowry ' ego. Cząsteczką H2O, ponieważ oddaje proton, jest kwas Brønsted-Lowry.
ćwiczenie budowania umiejętności
-
kofeina (C8H10N4O2) jest stymulantem występującym w kawach i herbatach. Po rozpuszczeniu w wodzie może przyjąć proton z cząsteczki wody. Napisz równanie chemiczne dla tego procesu i zidentyfikuj kwas i zasadę Brønsted-Lowry ' ego.,
definicje Brønsteda-Lowry ' ego dotyczące kwasu i zasady mogą być stosowane w reakcjach chemicznych zachodzących w rozpuszczalnikach innych niż woda. Poniższy przykład ilustruje.
przykład 4
amidek sodu (NaNH2) rozpuszcza się w metanolu (CH3OH) i oddziela się na jony sodu i amidowe (NH2−). Jony amidowe reagują z metanolem, tworząc amoniak i Jon metoksylowy (CH3O−). Napisz zrównoważone równanie chemiczne dla tego procesu i zidentyfikuj kwas i zasadę Brønsteda-Lowry ' ego.,
roztwór
równanie reakcji jest między NH2− i CH3OH, aby NH3 i CH3O-jest następujące:
NH2−(solv) + CH3OH(ℓ) → NH3(solv) + CH3O−(solv)
Etykieta (solv) wskazuje, że gatunki są rozpuszczone w jakimś rozpuszczalniku, w przeciwieństwie do (aq), który określa wodny (H2O) roztwór. W tej reakcji widzimy, że Jon NH2 przyjmuje proton z cząsteczki CH3OH, aby utworzyć cząsteczkę NH3. Tak więc, jako akceptor protonów, NH2-jest bazą Brønsteda-Lowry ' ego. Jako donor protonu, CH3OH jest kwasem Brønsted-Lowry.,
ćwiczenie budowania umiejętności
-
chlorek Pirydyniowy (C5H5NHCl) rozpuszcza się w etanolu (C2H5OH) i oddziela się na jony pirydyniowe (C5H5NH+) i jony chlorkowe. Jon pirydyniowy może przenosić jon wodorowy do cząsteczki rozpuszczalnika. Napisz zrównoważone równanie chemiczne dla tego procesu i zidentyfikuj kwas i zasadę Brønsteda-Lowry ' ego.
dla Twojego zdrowia: reakcje kwasowo-zasadowe Brønsteda-Lowry 'ego w farmaceutykach
istnieje wiele interesujących zastosowań reakcji kwasowo-zasadowych Brønsteda-Lowry' ego w przemyśle farmaceutycznym., Na przykład, leki często muszą być rozpuszczalne w wodzie dla maksymalnej skuteczności. Jednak wiele złożonych związków organicznych nie jest rozpuszczalnych lub jest tylko słabo rozpuszczalnych w wodzie. Na szczęście te leki, które zawierają akceptujące protony atomy azotu (a jest ich dużo), można reagować rozcieńczonym kwasem solnym . Atomy azotu-działając jako zasady Brønsteda-Lowry ' ego-przyjmują jony wodorowe z kwasu, aby utworzyć jon, który zwykle jest znacznie bardziej rozpuszczalny w wodzie., Zmodyfikowane cząsteczki leku mogą być następnie wyizolowane jako sole chlorkowe:
RN(sl aq) + H+(AQ) → RNH+(aq) →Cl−(aq) RNHCl(S)
Gdzie RN reprezentuje niektóre związki organiczne zawierające azot. Etykieta (sl aq) oznacza „lekko wodnisty”, wskazując, że związek RN jest tylko słabo rozpuszczalny. Leki, które są modyfikowane w ten sposób, nazywane są solami chlorowodorku. Przykłady obejmują silny środek przeciwbólowy kodeina, który jest powszechnie podawany jako chlorowodorek kodeiny. Stosuje się również kwasy inne niż kwas solny. Kwas bromowodorowy, na przykład, daje sole bromowodoru., Dekstrometorfan, składnik wielu leków na kaszel, jest wydawany jako bromowodorek dekstrometorfanu. Towarzyszący rysunek pokazuje inny lek jako sól chlorowodorku.
nazwa tego leku wyjaśnia, że istnieje on w postaci soli chlorowodorku.
© Thinkstock
Concept Review Exercise
-
podaj definicje kwasu Brønsted-Lowry i zasady Brønsted-Lowry.,
odpowiedz
I
kluczowe wnioski
- kwas Bronsteda-Lowry 'ego jest donorem protonów, a zasada Bronsteda-Lowry' ego jest akceptorem protonów. Reakcje kwasowo-zasadowe Bronsteda-Lowry ' ego są zasadniczo reakcjami przenoszenia protonów.
ćwiczenia
I
-
wyjaśnij, dlaczego podstawę Bronsteda-Lowry ' ego można nazwać akceptorem protonów.Napisz równanie chemiczne reakcji amoniaku w wodzie i oznacz kwas i zasadę Bronsteda-Lowry ' ego.,
-
napisz równanie chemiczne reakcji metyloaminy (CH3NH2) w wodzie i oznacz kwas i zasadę Brønsteda-Lowry ' ego.
-
wykazać, że rozpuszczenie HNO3 w wodzie jest w rzeczywistości reakcją kwasowo-zasadową Brønsteda-Lowry 'ego, opisując ją równaniem chemicznym i oznaczając kwas i zasadę Brønsteda-Lowry' ego.,
-
Zidentyfikuj kwas i zasadę Brønsteda-Lowry ' ego w następującym równaniu chemicznym:
C3H7NH2(AQ) + H3O+(AQ) → C3H7NH3+(AQ) + H2O(ℓ)
-
napisz równanie chemiczne dla reakcji zachodzącej, gdy chlorowodorek kokainy c17h22clno4) rozpuszcza się w wodzie i przekazuje Proton cząsteczce wody. (Gdy wodorochloidy rozpuszczają się w wodzie, rozdzielają się na jony chlorkowe i odpowiedni kation.)
-
Jeśli bromowodorek kodeiny ma wzór C18H22BrNO3, to jaki jest wzór związku macierzystego kodeiny?,