wprowadzenie
Alkenes i alkiny są węglowodorami, które odpowiednio mają podwójne wiązanie węgiel-węgiel i potrójne Wiązanie węgiel-węgiel. Wzory cząsteczkowe tych nienasyconych węglowodorów odzwierciedlają wielokrotne Wiązanie grup funkcyjnych:
alkeny są nazywane tak, jakby były alkanami, ale przyrostek „-ane” zmienia się na „-ene”., Jeśli Alken zawiera tylko jedno wiązanie podwójne i to wiązanie podwójne jest końcowe (wiązanie podwójne znajduje się na jednym końcu cząsteczki lub innym), to nie jest konieczne umieszczanie żadnej liczby przed nazwą.,
Butan: C4H10 (CH3CH2CH2CH3)
buten: C4H8 (CH2=CHCH2CH3)
Jeśli wiązanie podwójne nie jest końcowe (jeśli znajduje się na węglu gdzieś w środku łańcucha), wówczas węgle powinny być ponumerowane w taki sposób sposób, aby dać pierwszy z dwóch podwójnie połączonych węgli najniższą możliwą liczbę, a liczba ta powinna poprzedzać przyrostek „ENE” myślnikiem, jak pokazano poniżej.,
poprawny: pent-2-ene (CH3CH=CHCH2CH3)
niepoprawny: pent-3-ene (CH3CH2CH=CHCH3)
drugi jest niepoprawny, ponieważ odwrócenie wzoru poziomo powoduje mniejszą liczbę dla alkenu.
Jeśli w alkenie jest więcej niż jedno wiązanie podwójne, wszystkie wiązania powinny być ponumerowane w nazwie cząsteczki – nawet końcowe wiązania podwójne. Liczby powinny przejść od najniższej do najwyższej i być oddzielone od siebie przecinkiem. Prefiksy numeryczne IUPAC są używane do oznaczania liczby podwójnych wiązań.,
octa-2,4-Dien: CH3CH=CHCH=CHCH2CH2CH3
deca-1,5-Dien: CH2=CHCH2CH2CH=CHCH2CH2CH2CH3
zauważ, że numeracja „2-4” powyżej daje cząsteczkę z dwoma podwójnymi wiązaniami oddzielonymi tylko jednym pojedynczym wiązaniem. Wiązania podwójne w takim stanie nazywane są „sprzężonymi” i reprezentują zwiększoną stabilność konformacji, więc są energetycznie faworyzowane jako reagenty w wielu sytuacjach i kombinacjach.,
| Alkan | CnH2n+2 | jest to maksymalny stosunek H/C dla danej liczby atomów węgla. |
|---|---|---|
| Alken | CnH2n | każde wiązanie podwójne zmniejsza liczbę atomów wodoru o 2. |
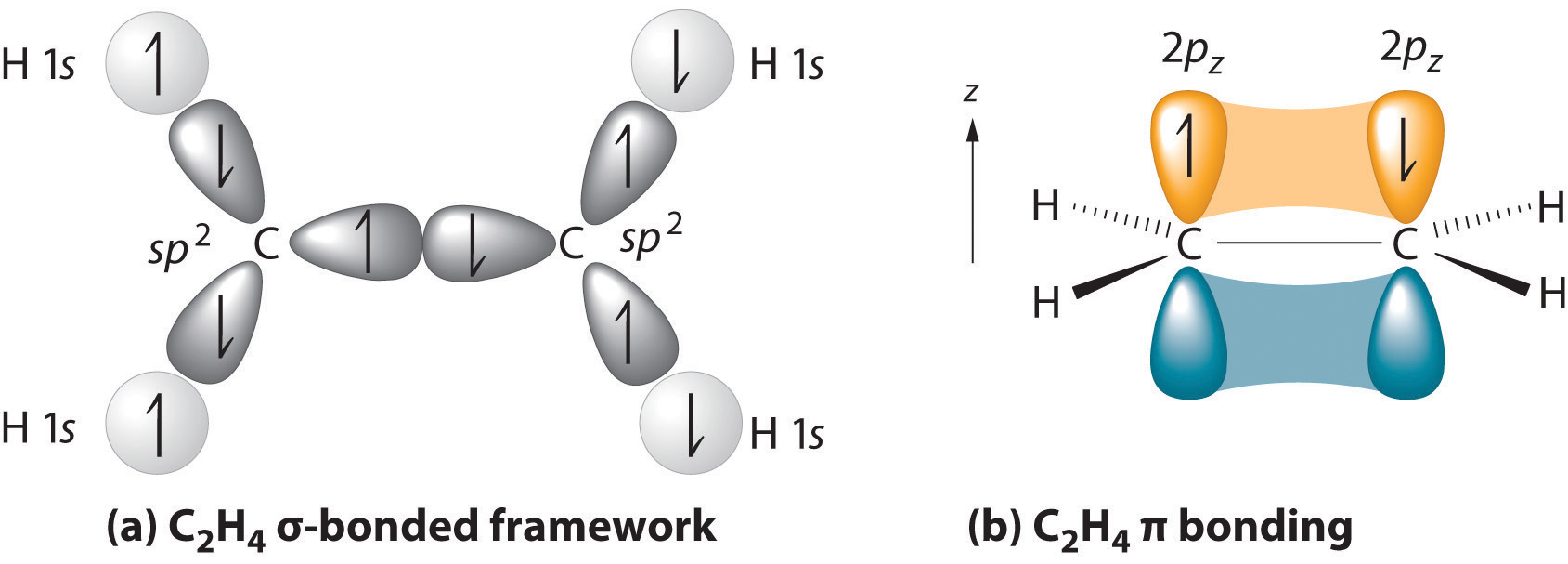
struktura macierzysta jest najdłuższym łańcuchem zawierającym oba atomy węgla wiązania podwójnego., Dwa atomy węgla wiązania podwójnego i cztery atomy dołączone do nich leżą w płaszczyźnie, o kątach wiązania około 120° wiązanie podwójne składa się z jednego wiązania sigma utworzone przez nakładanie się orbitali hybrydowych SP2 i jednego wiązania pi utworzone przez nakładanie się równoległych orbitali 2 p
Wzór cząsteczkowy węglowodorów dostarcza informacji o możliwych typach strukturalnych, które może reprezentować. Na przykład rozważmy związki o wzorze C5H8., Wzór pięciowęglowego pentanu alkanu to C5H12, więc różnica w zawartości wodoru wynosi 4. Ta różnica sugeruje, że takie związki mogą mieć Wiązanie potrójne, dwa wiązania podwójne, pierścień plus wiązanie podwójne lub dwa pierścienie. Niektóre przykłady są tutaj pokazane, A jest co najmniej czternaście innych!