do tej pory przyjrzeliśmy się sposobom, w jaki pary orbitali atomowych mogą się łączyć, tworząc orbitale molekularne-tworząc wiązania. Tak jak myślimy o postępie orbitali atomowych od najniższej energii do najwyższej (1s, 2s, 2P, 3s…), możemy uporządkować te orbitale molekularne według kolejności ich energii.
w dużym stopniu można uznać, że kolejność orbitali molekularnych w energii wynika z kolejności orbitali atomowych, z których są zbudowane., Czasami zdarzają się odstępstwa od tej zasady, ale to najprostsze miejsce na początek. Tak więc, w cząsteczce, orbitale molekularne o najniższej energii byłyby tymi utworzonymi z orbitali atomowych o najniższej energii, orbitali 1s.
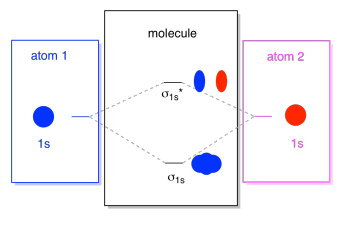
to, co widzimy tutaj, to diagram interakcji orbitali molekularnych. Środek diagramu to tylko diagram energii orbitali molekularnych. Jest analogiczny do diagramu energii orbitali atomowych (czyli 1s, 2s, 2P, 3s…). Dotychczasowy porządek energii to σ1s, σ1s*., Boki diagramu odnoszą się tylko do tego, skąd pochodzą te orbitale molekularne, z przerywanymi liniami, które prowadzą cię z jednego miejsca do drugiego. W sumie obraz mówi, że Orbital 1s na jednym atomie i orbital 1s na drugim atomie mogą łączyć się na dwa różne sposoby, produkując niższą energię, Wiązanie σ1s i wyższą energię, antybonding σ1s*.
zauważ, że nie dodaliśmy jeszcze żadnych elektronów do tego diagramu energii orbitali molekularnych, ale kiedy to zrobimy, wypełnimy je od dołu do góry, tak jak zrobilibyśmy diagram energii orbitali atomowych.,
kolejnym NAJNIŻSZYM zestawem orbitali atomowych jest poziom 2s. Te sferyczne orbitale połączyłyby się bardzo podobnie jak orbitale 1s i otrzymalibyśmy podobny schemat, tylko na nieco wyższym poziomie energetycznym.
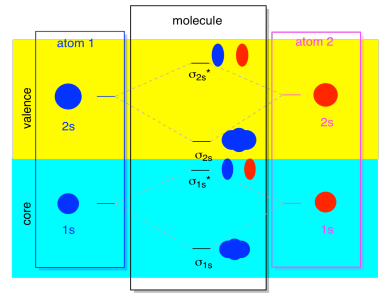
przez większość czasu nie widzimy zarówno σ1s, jak i σ2s wyświetlanych na diagramie. To dlatego, że jeśli są jakieś elektrony 2s, to te elektrony 1s są naprawdę elektronami rdzenia, a nie Walencją. Są zakopane trochę głębiej w atomie i nie odgrywają bardzo ważnej roli w wiązaniu., Ignorowanie elektronów rdzenia jest dość powszechne; jeśli pamiętacie, w atomowych konfiguracjach elektronowych możemy napisać 2s22p4 zamiast 1s22s22p4 dla tlenu; ignorowaliśmy rdzeń. Kiedy rysowaliśmy struktury Lewisa, daliśmy tlenu sześć elektronów, a nie osiem; ignorowaliśmy jądro.
w kontekście MO Załóżmy, że mamy elektrony 2s. Oznacza to, że każdy atom ma dwa elektrony 1s, w sumie cztery. Gdy te cztery elektrony zostaną wypełnione na diagramie MO od dołu do góry, zajmą zarówno Wiązanie σ1s, jak i antybonding σ1s*., Efekt zajęcia obu tych kombinacji polega na anulowaniu wiązania; te dwie pary elektronów pozostają nierozwiązane. Więc możemy je zignorować i tak naprawdę nic nam nie umknie.
orbitale 2s nie są jedynymi w drugiej powłoce. Istnieją również orbitale 2p. Pamiętaj, że istnieje kilka bardzo różnych sposobów, w jaki orbitale p mogą łączyć się ze sobą, w zależności od osi, które leżą. Jeśli nie leżą równolegle do siebie – to znaczy, jeśli są prostopadłe do siebie, takie jak px i py – to nie mogą wchodzić ze sobą w interakcje w ogóle., Pz na jednym atomie może oddziaływać z pz na drugim atomie, jednak, ponieważ są one równoległe do siebie.
zazwyczaj definiujemy oś z jako leżącą wzdłuż linii między dwoma atomami, na które patrzymy. Dwa orbitale pz leżałyby wzdłuż tej osi, każdy z płatem rozciągającym się w przestrzeni między atomami, a każdy z innym płatem rozciągającym się w innym kierunku
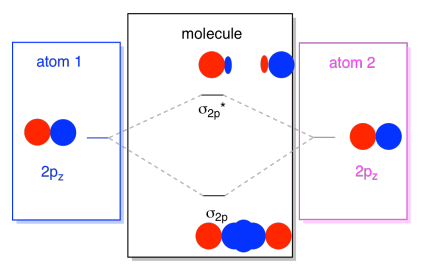
powstałe kombinacje nazywane są σ, ponieważ leżą wzdłuż osi między atomami (dokładnie to oznacza σ, w kategoriach wiązania)., Istnieje kombinacja σ, jeśli nakładające się płaty są ze sobą w fazie, i σ * kombinacja, jeśli płaty te są ze sobą w fazie. Ponieważ te nowe orbitale powstają z atomowych orbitali 2p, nazywamy je σ2p i σ2p*.
istnieją również takie orbitale p, które nie leżą wzdłuż osi wiązania, lub osi między dwoma atomami. Orbitale px są prostopadłe do orbitali pz, na które właśnie patrzyliśmy, a więc prostopadłe do osi między wiązaniami. Jednak nadal są one równoległe do siebie i nadal mogą tworzyć kombinacje., Te dwa orbitale tworzyłyby kombinację w fazie i kombinację poza fazową.
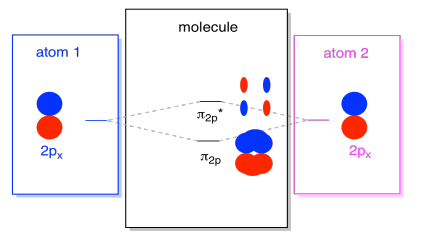
zauważ, że rozdzielenie energetyczne między tymi dwoma kombinacjami jest nieco mniejsze niż różnica między poziomami σ2p i σ2p*. Różnica jest związana ze stopniem nakładania się orbitali atomowych. Orbitale na osi rzutują silnie w tę samą przestrzeń; dużo na siebie nakładają i silnie oddziałują. Orbitale pozaosiowe zbliżają się do siebie, oddziałując mniej silnie i powodując mniejsze zmiany energetyczne., Różnica między orbitalem N2P i orbitalem N2P* jest więc znacznie mniejsza niż różnica między orbitalami σ2p i σ2p*.
w rzeczywistości są dwa takie pozaosiowe orbitale P. Oprócz zestawu px, mielibyśmy zestaw py. Jeśli zestaw px Znajduje się w płaszczyźnie ekranu, Zestaw py ma jeden orbital wystający z przodu i jeden ukryty z tyłu. Niemniej jednak, kombinacje pomiędzy dwoma orbitalami py są dokładnie takie same jak to, co widzieliśmy między dwoma orbitalami px. Są one po prostu obrócone w prostopadłą płaszczyznę w odniesieniu do kombinacji px.,
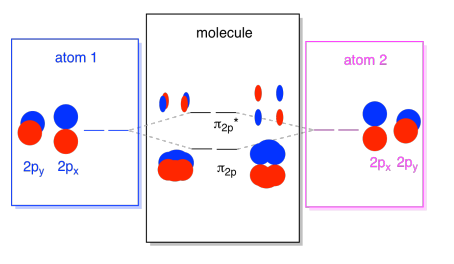
możemy umieścić wszystkie te orbitale 2p razem w jednym diagramie. Zaczyna się robić trochę bardziej tłoczno, ale ten schemat jest tylko kombinacją elementów, które już widzieliśmy. Zauważ, że wszystkie orbitale atomowe px, py i pz zaczynają się z tą samą energią (ustawiliśmy je tutaj tak, aby nadal można było zobaczyć korelację między orbitalami atomowymi i molekularnymi). Oznacza to, że orbitale N2P & orbitale N2P* będą „zagnieżdżone” między σ2p & σ2p* orbitale.,
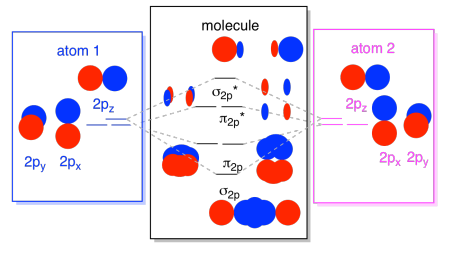
wreszcie, pamiętając, że orbitale 2p mają wyższą energię niż orbitale 2s, możemy połączyć te zdjęcia w jeden diagram. I znowu, widzieliśmy już te pojedyncze elementy; dopiero teraz je składamy.
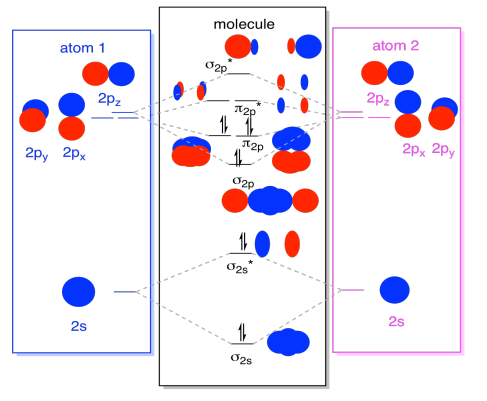
gdy już przy tym jesteśmy, możemy dodać elektrony. Jak? To tylko całkowita liczba elektronów walencyjnych. Dla przykładu użyliśmy N2., Każdy azot ma pięć elektronów walencyjnych, w sumie dziesięć, więc właśnie wypełniliśmy dziesięć elektronów, zaczynając od dołu diagramu poziomu energii orbitali molekularnych. Gdyby była to inna cząsteczka, taka jak F2 lub O2, skonstruowalibyśmy ogólny diagram w podobny sposób, ale po prostu użylibyśmy innej liczby elektronów.
obraz orbitalny, który opisaliśmy powyżej, jest tak naprawdę potencjalnym obrazem struktury elektronicznej dinitrogenu (i każdej innej głównej grupy lub dwuatomowego bloku p)., Nie uzyskamy prawdziwego obrazu struktury dinitrogenu, dopóki nie wypełnimy tych potencjalnych poziomów elektronami.
- tylko poziomy energii z elektronami mają wpływ na energię (i zachowanie) cząsteczki.
innymi słowy, energia elektronów determinuje zachowanie cząsteczki. Pozostałe poziomy energii są tylko możliwościami, które pozostają niespełnione.
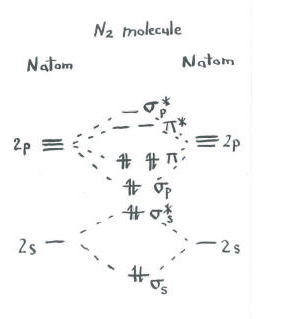
pomyśl o zdjęciu dinitrogenu.
- każdy azot ma pięć elektronów walencyjnych.
- jest w sumie dziesięć elektronów.,
- po dwa przechodzą na poziomy s S I S S*. Pamiętaj, że trzymaliśmy je oddzielnie od zestawu p jako uproszczenie.
- po dwa przechodzą do wiązania s p i każdego z poziomów wiązania P.
Pozostałe orbitale (S P* antibonding i każdy z poziomów P * antibonding) są nieobsadzone. Są to wyimaginowane poziomy, które nie odgrywają roli w określaniu energii dinitrogenu. W rzeczywistych obliczeniach orbitali molekularnych elektrony na tych poziomach przyczyniłyby się do ogólnej energii cząsteczki.,
otrzymujemy dodatkowe informacje z tego zdjęcia. Na przykład możemy zobaczyć kolejność wiązania w dinitrogenie.
- kolejność wiązań to tylko liczba wiązań między parą atomów.
- kolejność wiązań jest jednym z kilku czynników wpływających na siłę wiązania kowalencyjnego.
- im wyższy porządek wiązania, tym więcej elektronów jest dzielonych między atomami i tym silniejsze jest Wiązanie.
Jedna para ma mniejszą energię niż w atomie, ale druga jest wyższa., Nie ma obniżania energii netto. Elektrony te nie przyczyniają się do wiązania azotowo-azotowego. Są to niespajające pary elektronów.
sześć elektronów w wiązaniu s p i poziomach wiązania p reprezentuje jednak spadek energii w stosunku do poziomów energii w wolnych atomach azotu. Te trzy niskoenergetyczne pary elektronów wskazują na trzy wiązania między atomami azotu.
pamiętaj, że na tym zdjęciu zrobiliśmy kilka skrótów, a prawdziwe obliczenie orbitali molekularnych może dać nieco inne wyniki., Niemniej jednak, nadal ujawniłby kolejność wiązania trzech, jak również dwóch niepowiązujących par elektronowych.
ponadto czasami obrazy orbitali molekularnych są pokazywane na różne sposoby. Diagram interakcji orbitali molekularnych pokazuje, w jaki sposób orbitale atomowe lub molekularne łączą się ze sobą, tworząc nowe orbitale. Czasami możemy być zainteresowani tylko poziomami energii orbitali molekularnych, a nie tym, skąd pochodzą. Diagram poziomu energii orbitali molekularnych pokazuje tylko poziomy energii w cząsteczce., Często, ale nie zawsze, diagramy poziomu energii są pokazywane bez żadnych zdjęć orbitali, aby skupić uwagę na poziomach energii, które w fundamentalny sposób są najważniejszą częścią obrazu. Ponadto, ponieważ tylko zajęte poziomy energii faktycznie przyczyniają się do energii cząsteczki, czasami niezajęte orbitale o wyższej energii są pomijane.

bardzo często wyniki obliczeń orbitali molekularnych wzmacniają to, co przewidywalibyśmy na podstawie struktur Lewisa., Jeśli narysujesz strukturę Lewisa dinitrogenu, przewidzisz również potrójne Wiązanie azot-azot. Główną zaletą teorii orbitali molekularnych jest to, że pozwala na ilościowe przewidywanie energii, gdy wykonujemy rzeczywiste obliczenia na komputerze. Ponadto ważne jest, aby zdać sobie sprawę, że nie ma prawdziwego powodu dla reguły oktetu, chyba że weźmiemy pod uwagę mechanikę kwantową. Struktury Lewisa opierają się na empirycznej obserwacji, że elektrony tworzą pary i oktety, bez próby wyjaśnienia dlaczego., Teoria orbitali molekularnych bierze pewne fundamentalne związki z fizyki i stosuje je do bardzo skomplikowanych cząsteczek z bardzo dużym powodzeniem. Tylko znając liczbę elektronów w cząsteczce i wiedząc w przybliżeniu, gdzie znajdują się jądra w strukturze, obliczenia orbitali molekularnych dają bardzo przydatne informacje o energii. Ponadto, w bardziej skomplikowanych przypadkach niż N2, obliczenia te mogą nawet skorygować nasze pierwsze przypuszczenie o geometrii molekularnej i gdzie znajdują się wiązania.,
ćwiczenie \(\PageIndex{2}\)
diagram orbitali molekularnych dla dwuatomowej cząsteczki (dwóch atomów) różni się liczbą elektronów. Jak wypełniać elektrony?
Odpowiedz
* Policz elektrony walencyjne na cząsteczce. To liczba elektronów walencyjnych na każdym atomie, dostosowana do dowolnego ładunku na cząsteczce. (np. C22-ma 10 elektronów walencyjnych: 4 z każdego węgla – czyli 8 – i jeszcze dwa dla ładunku 2).
* najpierw napełnij elektrony orbitalami o najniższej energii.
• pary elektronów po wszystkich orbitalach na tym samym poziomie energetycznym mają jeden elektron.,
ćwiczenie \(\PageIndex{3}\)
Porównaj kolejność wiązania z tą widzianą w strukturze Lewisa (pamiętaj, że elektron w orbitalu antybondingowym anuluje stabilizację z powodu wiązania elektronu w orbitalu wiązania).
Odpowiedz 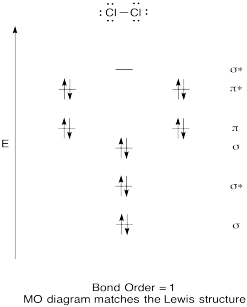
ćwiczenie \(\PageIndex{4}\)
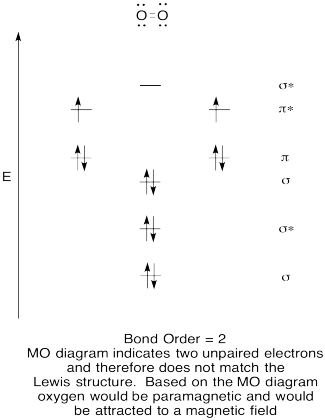
- skonstruuj jakościowy schemat orbitali molekularnych dla Tlenu, O2.
- Porównaj kolejność wiązań z tą widzianą w strukturze Lewisa.,
- jak inaczej Ten obraz MO tlenu porównuje się do struktury Lewisa? Co te dwie struktury mówią o parowaniu elektronów?
- związki, które mają wszystkie swoje elektrony sparowane, są określane jako diamagnetyczne. Te z niesparowanymi elektronami są określane jako paramagnetyczne. Materiały paramagnetyczne są przyciągane przez pole magnetyczne, ale diamagnetyczne rzeczy nie są. Jak powinien zachowywać się tlen molekularny?,
Odpowiedz
ćwiczenia \(\PageIndex{5}\)
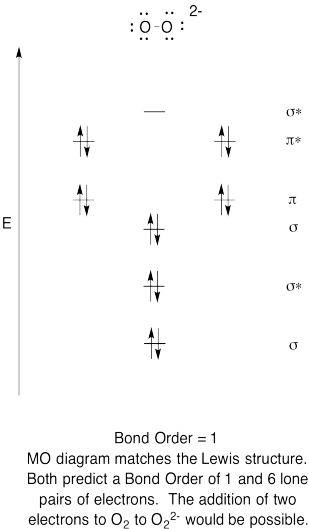
- skonstruuj jakościowy schemat orbitali molekularnych dla anionu nadtlenkowego, O22-.
- Porównaj kolejność wiązań z tą widzianą w strukturze Lewisa.
- jak inaczej Ten obraz MO tlenu porównuje się do struktury Lewisa? Co te dwie struktury mówią o parowaniu elektronów?,
- na podstawie zdjęć orbitali molekularnych, jak myślisz, jak łatwo dioksygen może zostać zredukowany do nadtlenku (poprzez dodanie dwóch elektronów)?
odpowiedź
ćwiczenie \(\PageIndex{6}\)
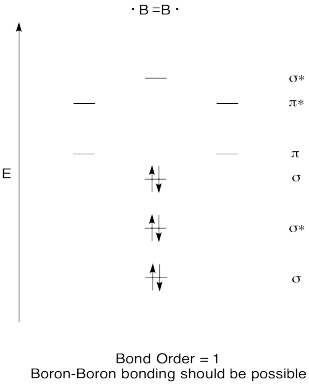
skonstruuj jakościowy diagram orbitali molekularnych dla diboronu, B2. Myślisz, że wiązania boru-boru mogą się łatwo formować na podstawie tego obrazu?,
Odpowiedz
ćwiczenie \(\PageIndex{7}\)
- Konstruuj jakościowy schemat orbitali molekularnych dla dikarbonu, C2.
- Porównaj kolejność wiązań z tą widzianą w strukturze Lewisa.
- jak inaczej Ten obraz MO tlenu porównuje się do struktury Lewisa? Co te dwie struktury mówią o parowaniu elektronów?,
Odpowiedz
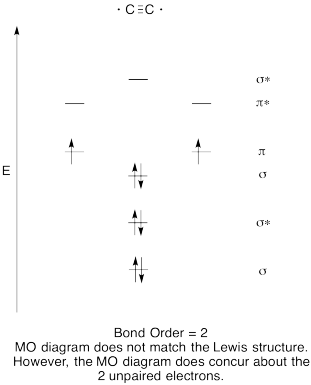
ćwiczenia \(\PageIndex{8}\)
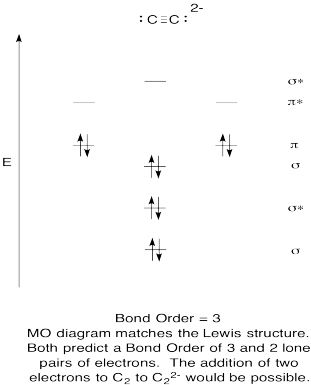
- skonstruuj jakościowy schemat orbitali molekularnych dla anionu acetyloidowego, C22-.
- Porównaj kolejność wiązań z tą widzianą w strukturze Lewisa.
- jak inaczej Ten obraz MO tlenu porównuje się do struktury Lewisa? Co te dwie struktury mówią o parowaniu elektronów?,
- na podstawie zdjęć orbitali molekularnych, jak myślisz, jak łatwo można zredukować dikarbon do acetylidu (poprzez dodanie dwóch elektronów)?
Odpowiedz
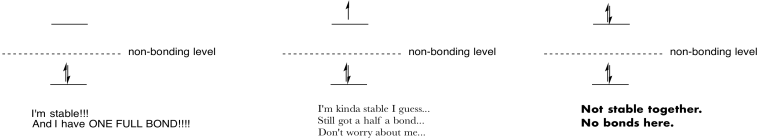
ćwiczenie \(\PageIndex{9}\)
wykonaj rysunki i notatki, aby podsumować efekt wypełniania orbitali antybondingowych.
Odpowiedz
,, (College of Saint Benedict / Saint John ' s University)