Richard Baxter en Jim Britton
hoe corrodeert staal in water?
om de kathodische bescherming te begrijpen, moet u eerst begrijpen hoe corrosie wordt veroorzaakt. Voor corrosie moeten drie dingen aanwezig zijn:
1. Twee ongelijksoortige metalen
2. Een elektrolyt (water waarin alle soorten zout of zouten zijn opgelost)
3., Een metalen (geleidende) pad tussen de ongelijksoortige metalen
de twee ongelijksoortige metalen kunnen totaal verschillende legeringen zijn-zoals staal en aluminium – maar hebben meer kans op microscopische of macroscopische metallurgische verschillen op het oppervlak van een enkel stuk staal. In dit geval zullen we vrij corroderend staal, dat niet-uniform overwegen.
als de bovenstaande omstandigheden bestaan, vindt de volgende reactie plaats op de meer actieve plaatsen: (twee ijzerionen plus vier vrije elektronen).,
2Fe = > 2Fe++ + 4e-
de vrije elektronen reizen door het metaalpad naar de minder actieve plaatsen, waar de volgende reactie plaatsvindt: (zuurstofgas wordt omgezet in zuurstofion – door te combineren met de vier vrije elektronen – die samen met water hydroxylionen vormen).
O2 + 4e- + 2H20 => 4 Oh-
Recombinaties van deze ionen aan het actieve oppervlak produceren de volgende reactie, die het ijzercorrosieproduct ferrohydroxide oplevert: (ijzer combineert met zuurstof en water om ferrohydroxide te vormen).,
2Fe + O2 + 2H2O => 2Fe (OH)2
Deze reactie wordt vaker beschreven als ” stroomstroom door het water van de anode (meer actieve locatie) naar de kathode (minder actieve locatie).”
hoe stopt kathodische bescherming corrosie?
kathodische bescherming voorkomt corrosie door alle anodische (actieve) plaatsen op het metaaloppervlak om te zetten in kathodische (passieve) plaatsen door elektrische stroom (of vrije elektronen) van een alternatieve bron te voorzien.
Dit neemt meestal de vorm aan van galvanische anoden, die actiever zijn dan staal., Deze praktijk wordt ook wel een opofferingssysteem genoemd, omdat de galvanische anoden zichzelf opofferen om het constructiestaal of de pijpleiding te beschermen tegen corrosie.
bij aluminiumanoden is de reactie aan het aluminiumoppervlak: (vier aluminiumionen plus twaalf vrije elektronen)
4Al = > 4AL+++ + 12 e –
en aan het oppervlak van het staal: (zuurstofgas omgezet in zuurstofionen die samen met water hydroxylionen vormen).,
3O2 + 12e – + 6H20 = > 12OH-
zolang de stroom (vrije elektronen) sneller bij de kathode (staal) aankomt dan zuurstof arriveert, zal er geen corrosie optreden.,
Standaard overwegingen bij het ontwerpen van sacrificial anode systemen
De elektrische stroom een anode lozingen wordt geregeld door de wet van Ohm, dat is:
I=E/R
I= stroom in ampère
E= het Verschil in potentiaal tussen de anode en de kathode, in volt
R= Totaal circuit weerstand (in ohm)
in eerste instantie, huidige hoog zullen zijn, omdat het verschil in potentiaal tussen de anode en kathode zijn hoog, maar als de potentiële verschil afneemt als gevolg van het effect van de stroom naar de kathode, de huidige geleidelijk afneemt als gevolg polarisatie van de kathode., De circuitweerstand omvat zowel het waterpad als het metalen pad, dat elke kabel in het circuit omvat. De dominante waarde is hier de weerstand van de anode tegen het zeewater.
voor de meeste toepassingen is de metaalbestendigheid zo klein in vergelijking met de waterbestendigheid dat deze kan worden genegeerd (hoewel dit niet het geval is voor sleden of lange pijpleidingen die tegen beide uiteinden zijn beschermd). In het algemeen hebben lange, dunne anoden een lagere weerstand dan korte, vette anoden. Ze zullen meer stroom lozen, maar zullen niet zo lang duren.,
daarom moet een ontwerper van kathodische bescherming de anoden zo groot maken dat ze de juiste vorm en oppervlakte hebben om voldoende stroom af te voeren om de structuur te beschermen en genoeg gewicht om de gewenste levensduur bij het ontladen van deze stroom mee te gaan.
als vuistregel geldt:
de lengte van de anode bepaalt hoeveel stroom de anode kan produceren en bijgevolg hoeveel vierkante voet staal kan worden beschermd. De doorsnede (gewicht) bepaalt hoe lang de anode dit niveau van bescherming kan handhaven.,
Impressed-current kathodische beschermingssystemen (ICCP-anode-systemen)
vanwege de hoge stromingen in veel zeewatersystemen is het niet ongewoon om impressed-current-systemen te gebruiken die anodes van een type (ICCP-anodes) gebruiken die niet gemakkelijk kunnen worden opgelost in metaalionen. Dit veroorzaakt een alternatieve reactie: de oxidatie van de opgeloste chloride-ionen.
2Cl-=> Cl2 + 2e –
het vermogen wordt geleverd door een externe DC-voedingseenheid.,

hoe weten we wanneer we voldoende kathodische bescherming hebben?
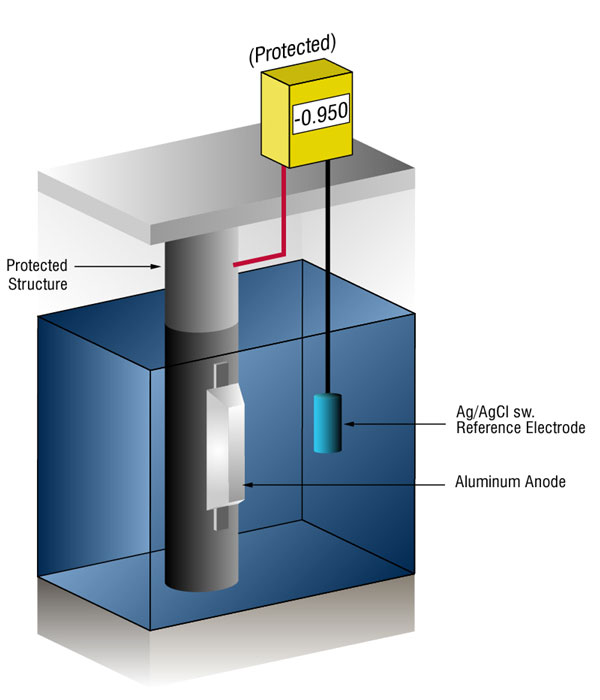
We kunnen controleren of er voldoende stroom is door het potentiaal van het staal te meten tegen een standaard referentieelektrode, meestal zilver zilver / chloride (Ag / AgCl sw.), maar soms zink (zw.).
stroom op een metaal zal zijn normale potentiaal in de negatieve richting verschuiven. De geschiedenis heeft aangetoond dat als staal genoeg stroom ontvangt om het potentieel te verschuiven naar ( – ) 0.800 v vs., silver / silver chloride (Ag / AgCl), the corrosion is essentially stopped.
 |
 |