categorie: Chemie
gepubliceerd: 9 December 2013
Ja, water kan vloeibaar blijven onder nul graden Celsius. Er zijn een paar manieren waarop dit kan gebeuren.
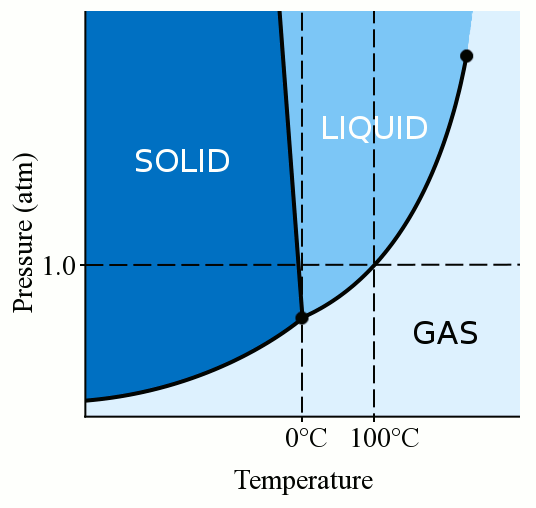
allereerst hangt de fase van een materiaal (of het nu gas, vloeistof of vaste stof is) sterk af van zowel de temperatuur als de druk., Voor de meeste vloeistoffen, het toepassen van druk verhoogt de temperatuur waarbij de vloeistof bevriest vast. Een vaste stof wordt gevormd wanneer de losse, meanderende moleculen van een vloeistof langzaam genoeg en dicht genoeg om stabiele bindingen die ze vastpinnen vormen. Wanneer we druk uitoefenen op een vloeistof, dwingen we de moleculen dichter bij elkaar te komen. Ze kunnen daardoor stabiele bindingen vormen en vast worden, zelfs als ze een hogere temperatuur hebben dan het vriespunt bij standaarddruk. Water is echter een beetje uniek. Watermoleculen verspreiden zich wanneer ze zich binden in een vaste kristallijne structuur., Deze uitspreidingsactie leidt ertoe dat ijs minder dicht is dan vloeibaar water, waardoor ijs drijft. Deze uitspreidende werking van de watermoleculen tijdens het invriezen betekent ook dat druk uitoefenen op water het vriespunt verlaagt. Als je voldoende druk uitoefent (waardoor het moeilijk wordt voor de watermoleculen om zich uit te spreiden in de vaste structuur), kun je vloeibaar water enkele graden onder nul graden Celsius hebben.
zelfs als u geen druk uitoefent, kunt u nog steeds vloeibaar water hebben bij temperaturen onder nul met behulp van additieven., Additieven zoals zout kunnen de chemische binding verstoren die nodig is om een vaste stof te vormen en kunnen daardoor het vriespunt van water verlagen. Zout bestaat uit sterke natrium-en chloorionen. Wanneer ze opgelost worden in water, blijven de watermoleculen meestal aan de zoutionen plakken in plaats van aan elkaar, en bevriezen ze daarom minder snel. Als je meer zout aan water toevoegt, blijft het vriespunt dalen totdat het water verzadigd is en geen zout meer kan vasthouden. Als je genoeg zout toevoegt, kan het vriespunt van water tot -21 graden Celsius dalen., Dit betekent dat water bij -21 graden Celsius nog vloeibaar kan blijven als er voldoende zout wordt toegevoegd. In plaats van vloeibaar water tegen bevriezing te houden, kan deze krachtige eigenschap van zout ook worden gebruikt om ijs terug te zetten in water. Zout besprenkelen op ijzige trottoirs verlaagt het vriespunt van het ijs tot onder de omgevingstemperatuur en het ijs smelt. Maar zout strooien op ijzige loopbruggen zal niet helpen als de omgevingstemperatuur lager is dan -21 graden Celsius. Het effect van zout op het vriespunt van water heeft ook diepgaande effecten op de oceanen op aarde.,
zelfs als u geen druk uitoefent en niets toevoegt aan het water, kunt u nog steeds vloeibaar water hebben bij temperaturen onder nul graden Celsius. Om water tot ijs te laten bevriezen, heeft het iets nodig om op te bevriezen om het proces te starten. We noemen deze uitgangspunten “nucleatiecentra”. In de meeste situaties, een beetje stof, onzuiverheid, of zelfs kleine trillingen in het water zorgen nucleatiecentra voor het water te bevriezen op. Maar als je water heel zuiver en heel stil is, is er niets waarop de watermoleculen kunnen kristalliseren., Hierdoor kun je heel zuiver water tot ver onder nul graden Celsius koelen zonder dat het bevriest. Water in deze toestand wordt “onderkoeld”genoemd. Bij standaarddruk kan zuiver water onderkoeld worden tot ongeveer -40 graden Celsius. Onderkoeld water wordt alleen door het ontbreken van nucleatiecentra tegen bevriezing gehouden. Daarom, zodra nucleatiecentra worden verstrekt (wat zo eenvoudig als een trilling zou kunnen zijn), bevriest het onderkoelde water snel. Ijzel is een natuurlijk voorbeeld van onderkoeld vloeibaar water., Zodra ijzel een object op het aardoppervlak raakt, levert dat object kernpunten, en de regen bevriest tot ijs.
onderwerpen: vriespunt, ijzel, ijzel, fasediagram, druk, onderkoeld, temperatuur, water