Learning Objectives
- om inzicht te krijgen in botstheorie.
- om inzicht te krijgen in de vier belangrijkste factoren die de reactiesnelheid beïnvloeden.
reactiekinetiek is de studie van de snelheid van chemische reacties, en de reactiesnelheid kan sterk variëren over een groot aantal tijdschalen. Sommige reacties kunnen explosief snel verlopen, zoals de ontploffing van vuurwerk (figuur 17.,1 “vuurwerk’ s nachts boven de rivier”), terwijl andere gedurende vele jaren in een traag tempo kunnen optreden, zoals het roesten van prikkeldraad dat aan de elementen is blootgesteld (figuur 17.2″verroest prikkeldraad”).
figuur 17.1. Vuurwerk ’s nachts boven rivier

de chemische reactie in vuurwerk gebeurt met een explosieve snelheid.
figuur 17.2. Geroest prikkeldraad

het roesten van prikkeldraad vindt plaats gedurende vele jaren.,
Botstheorie
om de kinetiek van chemische reacties te begrijpen en de factoren die de kinetiek beïnvloeden, moeten we eerst onderzoeken wat er gebeurt tijdens een reactie op moleculair niveau. Volgens de botstheorie van reactiviteit komen reacties voor wanneer reactieve moleculen ” effectief botsen.”Voor een” effectieve botsing “moeten de reactantmoleculen correct in de ruimte worden georiënteerd om het breken en vormen van bindingen en de herschikking van atomen te vergemakkelijken die resulteren in de vorming van productmoleculen (figuur 17.3″Botsingsvisualisaties”).
figuur 17.3., Botsingsvisualisaties
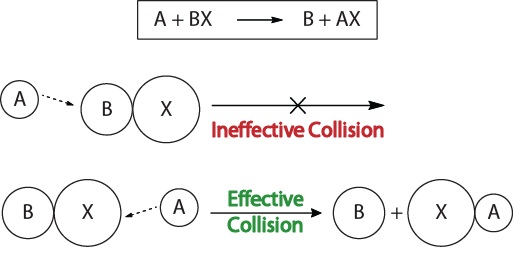
deze visualisatie toont een ineffectieve en effectieve botsing gebaseerd op moleculaire oriëntatie.
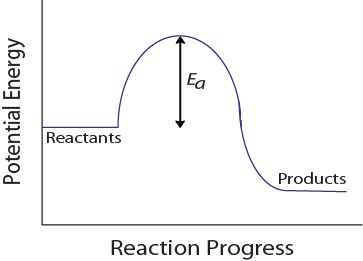
tijdens een moleculaire botsing moeten moleculen ook een minimale hoeveelheid kinetische energie bezitten om een effectieve botsing te laten plaatsvinden. Deze energie varieert per reactie en staat bekend als de activeringsenergie (EA) (figuur 17.4 “potentiële energie en activeringsenergie”)., De snelheid van reactie hangt daarom van de activeringsenergie af; een hogere activeringsenergie betekent dat minder molecules voldoende energie zullen hebben om een efficiënte botsing te ondergaan.
figuur 17.4. Potentiële energie en activeringsenergie
factoren die de snelheid beïnvloeden
Er zijn vier belangrijke factoren die de reactiesnelheid van een chemische reactie kunnen beïnvloeden:
1. Reactant concentratie., Het verhogen van de concentratie van een of meer reagentia zal vaak de snelheid van reactie verhogen. Dit komt omdat een hogere concentratie van een reactant zal leiden tot meer botsingen van die reactant in een specifieke periode.
2. Fysische toestand van de reagentia en oppervlakte. Als reactantmoleculen in verschillende fasen bestaan, zoals in een heterogeen mengsel, zal de reactiesnelheid worden beperkt door de oppervlakte van de fasen die in contact zijn., Bijvoorbeeld, als een vaste metaalreactant en gasreactant worden gemengd, kunnen slechts de molecules huidig op het oppervlak van het metaal met de gasmoleculen botsen. Daarom zal het verhogen van het oppervlak van het metaal door het plat te slaan of het in vele stukken te snijden de reactiesnelheid verhogen.
3. Temperatuur. Een stijging van de temperatuur verhoogt typisch De snelheid van reactie. Een temperatuurstijging zal de gemiddelde kinetische energie van de reactantmoleculen verhogen., Daarom zal een groter deel van de moleculen de minimale energie die nodig is voor een effectieve botsing (figuur. 17,5 “temperatuur en reactiesnelheid”).
figuur. 17.5 temperatuur en reactiesnelheid
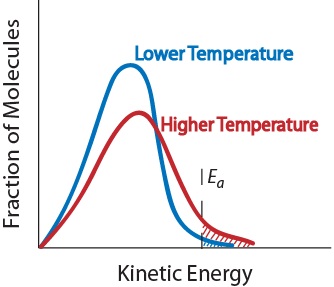
4. Aanwezigheid van een katalysator. Een katalysator is een stof die een reactie versnelt door eraan deel te nemen zonder verbruikt te worden. Katalysatoren bieden een alternatieve reactieweg om producten te verkrijgen., Ze zijn van cruciaal belang voor vele biochemische reacties. Zij zullen verder worden onderzocht in het hoofdstuk ” katalyse.”
belangrijke afhaalmomenten
- reacties treden op wanneer twee reactantmoleculen effectief botsen, elk met minimale energie en correcte oriëntatie.
- Reactantconcentratie ,de fysische toestand van de reactanten, oppervlakte, temperatuur en de aanwezigheid van een katalysator zijn de vier belangrijkste factoren die de reactiesnelheid beïnvloeden.