De studie van de kinetica stelt wetenschappers in staat om het verband tussen de veranderingen in omstandigheden en de snelheid van een bepaalde chemische reactie te bepalen. Een van de belangrijkste factoren die van invloed zijn op de snelheid van een reactie is de reactiviteit van chemicaliën die betrokken zijn bij die specifieke reactie; Bovendien zijn er verschillende variabelen die ook de snelheid van een reactie kunnen beïnvloeden (concentratie, temperatuur, katalysator, enz.).
een van deze variabelen wordt beschouwd als een botsing.,
elke chemische reactie vereist botsingen tussen de reactantdeeltjes (atomen en/of moleculen). Aan de andere kant bevorderen niet alle botsingen de reactie. In plaats daarvan, als de botsende deeltjes niet voldoende kinetische energie of de juiste oriëntatie in de ruimte hebben, zal de reactie niet plaatsvinden.
maar wat wordt bedoeld met” voldoende energie “of”juiste oriëntatie”? Om een beter beeld te krijgen van de eerder genoemde Concepten, zal het artikel enkele algemene definities bevatten, vergezeld van overeenkomstige voorbeelden en voorbeeldproblemen.,
ons belangrijkste doel is om het concept van activeringsenergie te definiëren en uit te leggen waarom sommige botsingen niet resulteren in een reactie.
dienovereenkomstig zal dit artikel zich voornamelijk richten op het concept van reactieve botsing. Samen met dat, zullen we kort een overzicht van een aantal scenario ‘ s met niet-reactieve botsingen. Aangezien botsingen worden geassocieerd met twee belangrijke kenmerken, energie en ruimtelijke oriëntatie, zullen we deze termen ook bespreken.,
Botstheorie
zoals we hierboven al hebben vermeld, moeten botsingen tussen twee of meer moleculen plaatsvinden om een chemische reactie te kunnen laten plaatsvinden. Maar botsing is niet genoeg voor de reagentia om te worden omgezet in producten. Moleculen moeten genoeg energie hebben, en ze moeten botsen met de juiste ruimtelijke oriëntatie.
zoals u wellicht al weet, zijn er verschillende soorten reacties, waaronder synthese, ontleding, verplaatsing en verbranding., Gezien het feit dat de botstheorie zich richt op de reacties met botsingen tussen twee soorten, hoef je je niet veel zorgen te maken over ontbindingsreacties, omdat in dergelijke gevallen een enkele verbinding uit elkaar valt, en er geen noodzaak is om botsingen of oriëntatie van deeltjes in de ruimte te overwegen.
in het geval van reacties waarbij twee soorten betrokken zijn, zijn botsingen tussen de moleculen cruciaal om de reactie voort te zetten; maar alleen botsingen van moleculen met voldoende kinetische energie en relevante ruimtelijke oriëntatie kunnen een reactie veroorzaken., Aldus, is energie nodig om de banden binnen de reagerende molecules te breken, terwijl de oriëntatie van molecules in ruimte een belangrijke rol in het opstellen van juiste atomen met elkaar speelt om de gebroken banden op de juiste manier te hervormen.
wanneer aan beide criteria wordt voldaan, wordt de botsing beschouwd als een succesvolle, effectieve of reactieve botsing.
gezien het belang van de twee bovengenoemde factoren (energie en oriëntatie), moeten we doorgaan met de verdere uitleg van de termen en concepten om de principes van de botstheorie beter te begrijpen.,
activeringsenergie
zoals we eerder al zeiden, moeten deeltjes met voldoende energie botsen om een reactie te kunnen veroorzaken. Deze minimale energie die nodig is om de reactie voort te zetten wordt gedefinieerd als de activeringsenergie.,
zoals u wellicht weet, zijn er twee soorten reacties met betrekking tot het vrijkomen of de absorptie van energie:
- endotherme reactie – energie wordt geabsorbeerd in een reactie (meestal in vormen van warmte)
- exotherme reactie – energie wordt afgegeven in een reactie (meestal in vormen van warmte)
op het eerste gezicht lijkt het erop dat, aangezien energie vrijkomt in een exotherme reactie, er geen behoefte is om energie in te voeren.voor de reactie optreden. Integendeel, zowel endotherme als exotherme chemische reacties vereisen energie om te beginnen.,
Het lijkt een beetje vreemd, toch? Waarom heeft een reactie de input van energie nodig als de energie vervolgens vrijkomt?
laten we eens kijken naar de volgende voorbeelden van exotherme reacties die voorkomen in ons dagelijks leven.

Voorbeeld #1 – branden van een kaars
het branden van een kaars geeft energie vrij in de vorm van warmte; daarom is de reactie tijdens het proces exotherm. Uiteraard moet u de kaars aansteken met behulp van een lucifer of aansteker., Wat dit betekent is dat je wat energie moet invoeren om de kaars te laten oplichten. Daarna heeft de reactie voldoende energie om door te gaan naar de volgende stappen en blijft de kaars energie branden.
een kaars zal echter nooit vanzelf in vlammen opgaan, toch?
Voorbeeld # 2-belichten van een overeenkomst

een typische overeenkomende kop bestaat uit zwavel gemengd met verschillende oxiderende stoffen. Om de luciferstick te ontsteken, moet u de luciferkop tegen de speciale kant van een luciferdoosje wrijven., Tijdens dit proces vindt een reactie plaats en geeft energie vrij in vormen van licht en warmte. De reactie wordt dus als exotherm beschouwd. Hoewel, je moet nog steeds wat energie in te voeren voor de lucifer om te beginnen met branden. Deze energie wordt gedefinieerd met de term “activeringsenergie.”Net als in het vorige voorbeeld, zolang je voldoende energie levert om de lucifer op te lichten, zal hij blijven branden en warmte vrijgeven op zijn eigen.
activatie – energiegrafiek toont de energieveranderingen die optreden tijdens een chemische reactie.,
om de activeringsenergiegrafiek uit te beelden, is het van cruciaal belang twee variabelen in aanmerking te nemen:
- aantal botsingen tussen verschillende moleculen
- kinetische energie van de botsende moleculen
de eerste variabele is vrij gemakkelijk te begrijpen omdat hij een directe betekenis heeft – hij definieert het aantal botsingen tussen de deeltjes van twee soorten per seconde.
de tweede variabele is de kinetische energie van de botsende moleculen, die kan worden gedefinieerd als de energie van de beweging van de moleculen.
- endotherme reactie-energie wordt geabsorbeerd., De energie van reagentia is lager dan die van producten.
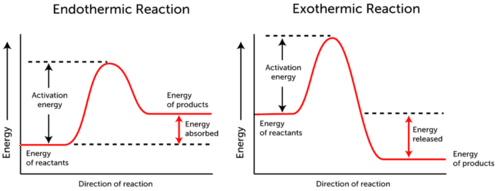
- exotherme reactie – energie wordt vrijgegeven. De energie van reagentia is meer dan de energie van producten.
zoals u kunt zien in de twee grafieken hierboven, is de activeringsenergie voor beide, endotherme en exotherme reacties hetzelfde.,
omdat de endotherme reactie niet zoveel energie kan produceren als nodig is om de reactie te laten plaatsvinden, wordt de energie geabsorbeerd; daarom is de energie van de producten hoger dan de energie van de reagentia.
integendeel, exotherme reacties produceren meer energie dan ze als activeringsenergie gebruiken. Hierdoor komt de energie vrij en hebben de producten minder energie dan de reagentia.,
als conclusie kan worden gesteld dat, zelfs als reactieve moleculen snel met elkaar botsen, het essentieel is dat de moleculen voldoende energie hebben om de reactie te laten plaatsvinden.
Ruimtelijke Oriëntatie
volgens de botstheorie zijn niet alle botsingen succesvol, zelfs niet als de reactantmoleculen voldoende activeringsenergie hebben. De moleculen moeten ook op de juiste manier rond botsen. het tweede aspect dat reactieve botsingen beïnvloedt wordt beschouwd als ruimtelijke oriëntatie (oriëntatie van moleculen in de ruimte).,
wat wordt bedoeld met de” juiste ” oriëntatie van moleculen in een reactie?
wanneer twee moleculen botsen, moeten beide moleculen zo gelegen zijn dat ze gemakkelijk kunnen reageren. Om het concept volledig te begrijpen, is het belangrijk om het mechanisme van de reactie te benadrukken.
laten we de reactie tussen propyleen (of propeen) en waterstofbromide als voorbeeld nemen:

zoals u hierboven kunt zien, verloopt de reactie in 2 stappen.,
Stap 1: de dubbele binding wordt verbroken
Stap 2: broom is gebonden
bij deze reactie spelen de moleculaire oriëntaties van HBr en C3H6 een belangrijke rol, aangezien een van hen zich op een andere manier bevond, zou het voor het H-atoom niet mogelijk zijn geweest om het propyleenmolecuul te benaderen.
Dit geldt voor elke reactie. Elke molecule moet de juiste oriëntatie in ruimte voor de reactie hebben om plaats te vinden. De juiste oriëntatie zorgt ervoor dat de molecules zich op de manier bevinden dat het voor hen vrij gemakkelijk is om te botsen en te reageren.,
We kunnen concluderen dat de gunstige oriëntatie van reactantmoleculen even essentieel is als voldoende activeringsenergie.
samenvatting
termen en concepten die in het hele artikel zijn gedefinieerd, zijn samengevat in de onderstaande tabel:
| Botsingstheorie | legt uit hoe de deeltjes moeten interageren of met elkaar een reactie kunnen veroorzaken., Volgens de Botstheorie moet aan twee criteria worden voldaan om een chemische reactie te laten plaatsvinden: moleculen moeten botsen met voldoende activeringsenergie om bestaande bindingen te breken en opnieuw te vormen; moleculen moeten botsen met een gunstige ruimtelijke oriëntatie. | succesvolle botsing (ook wel effectieve of reactieve botsing genoemd) | een botsing van moleculen met voldoende activeringsenergie en juiste oriëntatie in de ruimte die resulteert in een chemische reactie., |
| activeringsenergie | de minimale energie die nodig is voor de reactie. De input van energie is nodig in het geval van zowel endotherme als exotherme reacties. | endotherme reactie | energie (warmte) wordt geabsorbeerd; de energie van reagentia is lager dan de energie van producten; kan niet zoveel energie produceren als het verbruikt tijdens de reactie., | exotherme reactie | energie (warmte) komt vrij; de energie van reagentia is hoger dan de energie van producten; kan meer energie produceren dan het verbruikt tijdens de reactie. |
| moleculaire oriëntatie | ruimtelijke oriëntatie van moleculen., |
Three different scenarios are represented in the picture attached below:
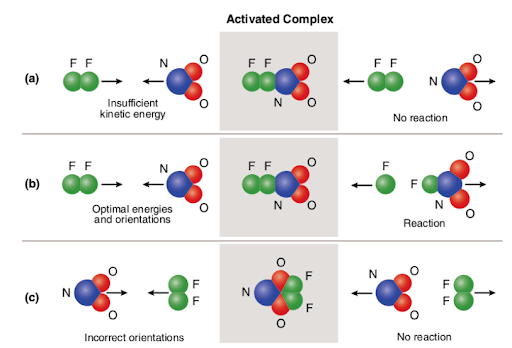
The picture summarizes the concept of collision theory utilizing two reactant molecules (fluorine (F2) and molecular nitrogen dioxide (NO2)) and three different cases to form nitrogen oxyfluoride.,
in het geval van (a) hebben de reactantmoleculen een goede ruimtelijke oriëntatie, maar hebben ze niet voldoende activeringsenergie; daarom vindt de reactie niet plaats omdat er niet genoeg energie is om bindingen te breken. De botsing tussen de twee moleculen wordt dus als niet-reactief beschouwd.
in het geval van B) hebben de reactantmoleculen zowel voldoende activeringsenergie als een juiste oriëntatie in de ruimte. Door de optimale eigenschappen van de moleculen verloopt de reactie en wordt stikstofoxyfluoride gevormd., De botsing tussen de twee moleculen wordt dus als reactief beschouwd.
in het geval van C) hebben de reactantmoleculen voldoende activeringsenergie, maar bevinden ze zich niet goed in de ruimte; daarom vindt de reactie niet plaats omdat het niet mogelijk is dat de moleculen elkaar bereiken op een manier die de bindingen verbreekt. Dus, net als in het eerste geval, wordt de botsing tussen de twee moleculen als niet-reactief beschouwd.