10.2 Brønsted-Lowry definitie van zuren en basen
leerdoelstellingen
- herkennen een verbinding als Brønsted-Lowry-zuur of als Brønsted-Lowry-base.
- illustreert het proton transfer proces dat een Brønsted-Lowry zuur-base reactie definieert.
leerdoelstellingen
- herkennen een verbinding als Brønsted-Lowry-zuur of als Brønsted-Lowry-base.
- illustreert het proton transfer proces dat een Brønsted-Lowry zuur-base reactie definieert.
ammoniak (NH3) verhoogt de hydroxideionenconcentratie in waterige oplossing door te reageren met water in plaats van hydroxideionen direct vrij te geven., In feite richten de Arrhenius-definities van een zuur en een base zich op waterstofionen en hydroxideionen. Zijn er meer fundamentele definities voor zuren en basen?in 1923 stelden de Deense wetenschapper Johannes Brønsted en de Engelse wetenschapper Thomas Lowry onafhankelijk nieuwe definities voor zuren en basen voor. In plaats van zowel waterstof-als hydroxideionen te overwegen, richtten ze zich alleen op het waterstofion. Een Brønsted-Lowry acidA verbinding die een waterstofion (H+) levert in een reactie; een proton donor. is een verbinding die een waterstof-ion levert in een reactie., Een Brønsted-Lowry basea verbinding die een waterstofion (h+) in een reactie accepteert; een proton acceptor. omgekeerd, is een verbinding die een waterstofion in een reactie accepteert. De Brønsted-Lowry definities van een zuur en een base richten zich dus op de beweging van waterstofionen in een reactie, in plaats van op de productie van waterstofionen en hydroxideionen in een waterige oplossing.
laten we de reactie van ammoniak in water gebruiken om de Brønsted-Lowry definities van een zuur en een base aan te tonen., Ammoniak en watermoleculen zijn reagentia, terwijl het ammoniumion en het hydroxide-ion producten zijn:
NH3(aq) + H2o(J) → NH4+(aq) + OH−(aq)
wat er in deze reactie is gebeurd is dat het oorspronkelijke watermolecuul een waterstof-ion heeft gedoneerd aan het oorspronkelijke ammoniakmolecuul, dat op zijn beurt het waterstof-ion heeft geaccepteerd. We kunnen dit als volgt illustreren:
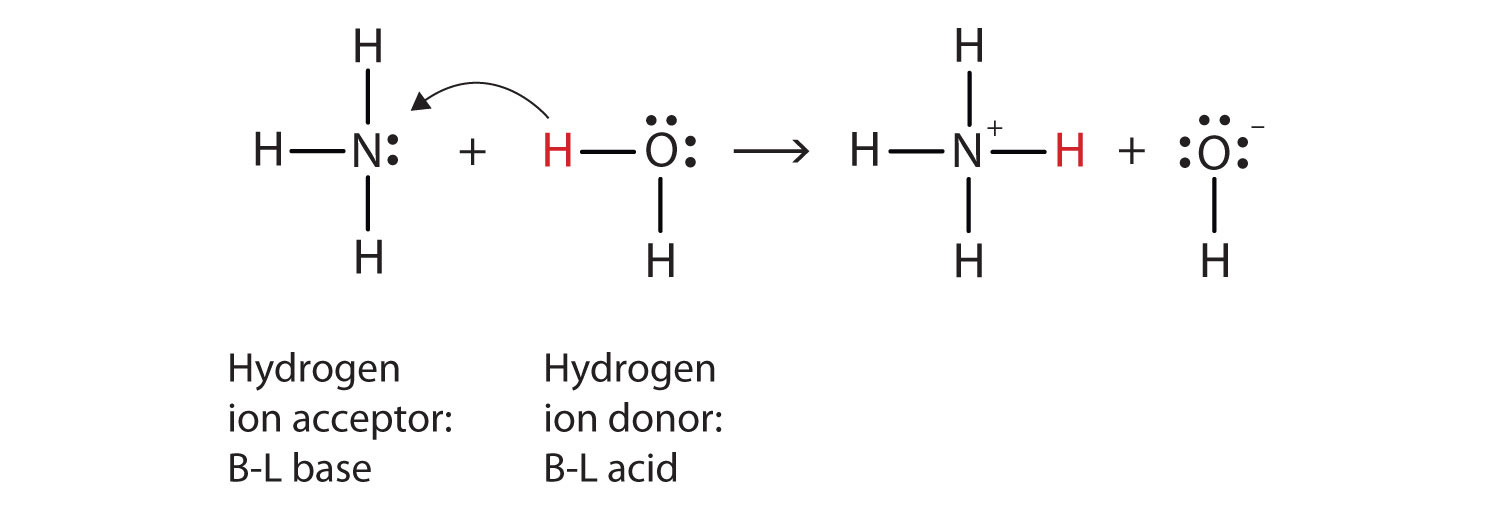
omdat het watermolecuul een waterstofion aan de ammoniak doneert, is het Brønsted-Lowry—zuur, terwijl het ammoniakmolecuul—dat het waterstofion accepteert-de Brønsted-Lowry-base is., Ammoniak fungeert dus als basis in zowel de Arrhenius-betekenis als de Brønsted-Lowry-betekenis.
is een Arrhenius-zuur zoals zoutzuur nog steeds een zuur in de Brønsted-Lowry-zin? Ja, maar het vereist dat we begrijpen wat er echt gebeurt als HCl wordt opgelost in water. Bedenk dat het waterstofatoom een enkel proton is omgeven door een enkel elektron. Om het waterstof-ion te maken, verwijderen we het elektron, waardoor een kaal proton overblijft. Drijven er echt kale protonen rond in waterige oplossing? Nee, dat doen we niet., Wat er echt gebeurt is dat het H + – ion zich aan H2O hecht om H3O+ te maken, wat het hydronium-ion wordt genoemd. Voor de meeste doeleinden vertegenwoordigen H+ en H3O+ dezelfde soort, maar het schrijven van H3O+ in plaats van H + laat zien dat we begrijpen dat er geen kale protonen rondzweven in oplossing. Deze protonen zijn eerder verbonden met oplosmiddelmoleculen.
opmerking
een proton in waterige oplossing kan worden omgeven door meer dan één watermolecuul, wat leidt tot formules als H5O2+ of H9O4+ in plaats van H3O+. Het is echter eenvoudiger om H3O+te gebruiken.,
met dit in gedachten, hoe definiëren we HCl als een zuur in de Brønsted-Lowry betekenis? Overweeg wat er gebeurt als HCl wordt opgelost in H2o:
HCl + H2o(J) → H3O+(aq) + Cl−(AQ)
We kunnen dit proces afbeelden met behulp van Lewis elektron dot diagrammen:
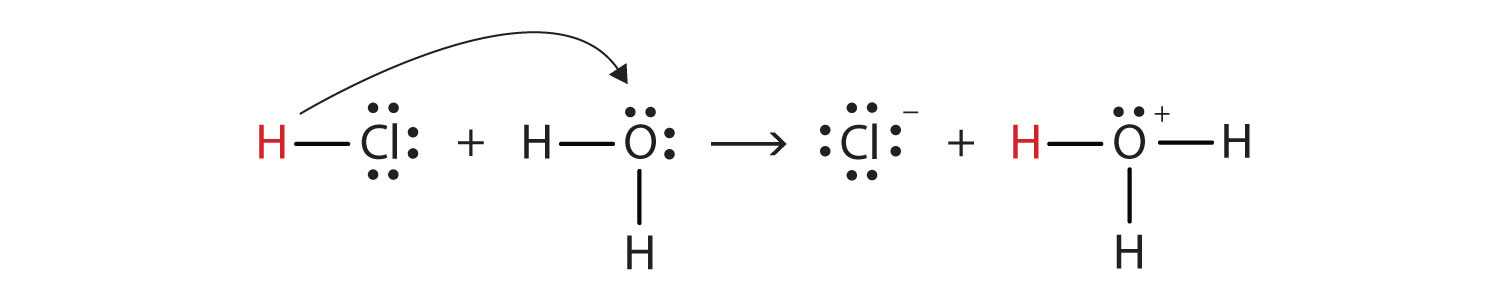
nu zien we dat een waterstofion wordt overgebracht van het HCl-molecuul naar het H2o-molecuul om chloride-ionen en hydronium-ionen te maken. Als waterstofiondonor fungeert HCl als een Brønsted-Lowry zuur; als waterstofionacceptor is H2o een Brønsted-Lowry base., HCl is dus niet alleen een zuur in de zin van Arrhenius, maar ook in de zin van Brønsted-Lowry. Bovendien is H2O volgens de Brønsted-Lowry-definities een base in de vorming van waterig HCl. Dus de Brønsted—Lowry definities van een zuur en een base classificeren het oplossen van HCl in water als een reactie tussen een zuur en een base-hoewel de Arrhenius definitie in deze omstandigheid geen H2o een base zou hebben gelabeld.
Note
alle Arrhenius-zuren en-basen zijn ook Brønsted-Lowry-zuren en-basen. Maar niet alle Brønsted-Lowry-zuren en-basen zijn Arrhenius-zuren en-basen.,
Voorbeeld 3
Aniline (C6H5NH2) is slecht oplosbaar in water. Het heeft een stikstofatoom dat een waterstof-ion van een watermolecuul kan accepteren, net zoals het stikstofatoom in ammoniak dat doet. Schrijf de chemische vergelijking voor deze reactie en identificeer het Brønsted-Lowry zuur en base.
oplossing
C6H5NH2 en H2O zijn de reagentia. Wanneer C6H5NH2 een proton van H2O accepteert, krijgt het een extra h en een positieve lading en laat het een OH-ion achter., De reactie is als volgt:
C6H5NH2(AQ) + H2o(J) → C6H5NH3+(aq) + OH−(aq)
omdat C6H5NH2 een proton accepteert, is het de Brønsted-Lowry basis. Het H2o-molecuul, omdat het een proton doneert, is het Brønsted-Lowry-zuur.
oefening om vaardigheden op te bouwen
-
cafeïne (C8H10N4O2) is een stimulerend middel dat wordt aangetroffen in koffie en thee. Wanneer opgelost in water, kan het een proton van een watermolecuul accepteren. Schrijf de chemische vergelijking voor dit proces en identificeer het Brønsted-Lowry zuur en base.,
De Brønsted-Lowry definities van een zuur en een base kunnen worden toegepast op chemische reacties die voorkomen in andere oplosmiddelen dan water. Het volgende voorbeeld illustreert.
Voorbeeld 4
Natriumamide (NaNH2) lost op in methanol (CH3OH) en scheidt af in natriumionen en amideionen (NH2−). De amide-ionen reageren met methanol om ammoniak en het methoxyde−ion (CH3O -) te maken. Schrijf een uitgebalanceerde chemische vergelijking voor dit proces en identificeer het Brønsted-Lowry zuur en base.,
oplossing
de vergelijking voor de reactie is tussen NH2− en CH3OH om NH3 te maken en CH3OH− is als volgt:
NH2−(solv) + CH3OH(J) → NH3(solv) + CH3O−(solv)
het etiket (solv) geeft aan dat de species zijn opgelost in een oplosmiddel, in tegenstelling tot (aq), die een waterige (H2o) oplossing specificeert. In deze reactie zien we dat het NH2− ion een proton van een CH3OH-molecuul accepteert om een NH3-molecuul te maken. Als Proton acceptor is NH2 dus de Brønsted-Lowry basis. Als protondonor is CH3OH het Brønsted-Lowry-zuur.,
Vaardigheidsopbouw
-
Pyridiniumchloride (C5H5NHCl) lost op in ethanol (C2H5OH) en scheidt af in pyridiniumionen (C5H5NH+) en chlorideionen. Het pyridiniumion kan een waterstofion overbrengen naar een oplosmiddelmolecuul. Schrijf een uitgebalanceerde chemische vergelijking voor dit proces en identificeer het Brønsted-Lowry zuur en base.
op uw gezondheid: Brønsted-Lowry zuur-Base reacties in geneesmiddelen
Er zijn veel interessante toepassingen van Brønsted-Lowry zuur-base reacties in de farmaceutische industrie., Geneesmiddelen moeten bijvoorbeeld vaak in water oplosbaar zijn voor maximale effectiviteit. Veel complexe organische verbindingen zijn echter niet of nauwelijks oplosbaar in water. Gelukkig kunnen die medicijnen die proton-accepterende stikstofatomen bevatten (en er zijn er veel van) reageren met verdund zoutzuur . De stikstofatomen-die fungeren als Brønsted—Lowry-basen-accepteren de waterstofionen uit het zuur om een ion te maken, dat meestal veel beter oplosbaar is in water., De gemodificeerde drugmoleculen kunnen dan worden geïsoleerd als chloridezouten:
RN(sl aq) + H+(aq) → RNH+(aq) →Cl−(aq) RNHCl (s)
waar RN een organische verbinding vertegenwoordigt die stikstof bevat. Het etiket (sl aq) betekent “licht waterig”, wat aangeeft dat de verbinding RN slechts licht oplosbaar is. Geneesmiddelen die op deze manier worden gewijzigd, worden hydrochloridezouten genoemd. De voorbeelden omvatten de krachtige pijnstillercodeine, die algemeen als codeinewaterstofchloride wordt beheerd. Andere zuren dan zoutzuur worden ook gebruikt. Hydrobromide geeft bijvoorbeeld hydrobromidezouten., Dextromethorfan, een ingrediënt in veel hoestmiddelen, wordt afgegeven als dextromethorfanhydrobromide. De bijbehorende figuur toont een ander medicijn als hydrochloridezout.
de naam van dit geneesmiddel maakt duidelijk dat het bestaat als hydrochloridezout.
© Thinkstock
Concept Review Exercise
-
Geef de definities van een Brønsted-Lowry zuur en een Brønsted-Lowry base.,
antwoord
-
een Brønsted-Lowry-zuur is een protondonor, terwijl een Brønsted-Lowry-base een protonacceptor is.
Key Takeaways
- Een Brønsted-Lowry-zuur is een protondonor en een Brønsted-Lowry-base is een protonacceptor.
- Brønsted-Lowry zuur-base reacties zijn in wezen proton transfer reacties.
oefeningen
-
Label elk reactief als een Brønsted-Lowry zuur of een Brønsted-Lowry base.,
HCl(aq) + NH3 (AQ) → NH4 + (AQ) + Cl−(AQ)
-
Label elk reactief als een Brønsted-Lowry zuur of een Brønsted-Lowry base.
H2O(J)+N2H4 (AQ) → N2H5 + (aq) + OH−(AQ)
-
leg uit waarom een Brønsted-Lowry zuur een proton donor kan worden genoemd.
-
leg uit waarom een Brønsted-Lowry base een proton acceptor kan worden genoemd.
-
schrijf de chemische vergelijking van de reactie van ammoniak in water en label het Brønsted-Lowry zuur en base.,
-
schrijf de chemische vergelijking van de reactie van methylamine (CH3NH2) in water en label het Brønsted-Lowry-zuur en-base.
-
aantonen dat de oplossing van HNO3 in water eigenlijk een Brønsted-Lowry zuur-base reactie is door deze te beschrijven met een chemische vergelijking en het Brønsted-Lowry zuur en base te etiketteren.,
-
Identificeer het Brønsted-Lowry-zuur en-base in de volgende chemische vergelijking:
C3H7NH2(aq) + H3O+(aq) → c3h7nh3+(AQ) + H2O(J)
-
schrijf de chemische vergelijking voor de reactie die optreedt wanneer cocaïnehydrochloride (C17H22ClNO4) lost op in water en doneert een proton aan een watermolecuul. (Wanneer hydrochloriden oplossen in water, scheiden ze zich af in chloride-ionen en het juiste kation.)
-
als codeïnehydrobromide de formule C18H22BrNO3 heeft, wat is de formule van de oorspronkelijke verbinding codeïne?,