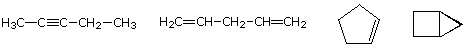Inleiding
alkenen en alkynen zijn koolwaterstoffen die respectievelijk koolstof-koolstof dubbele binding en koolstof-koolstof triple binding functionele groepen hebben. De molecuulformules van deze onverzadigde koolwaterstoffen weerspiegelen de meervoudige binding van de functionele groepen:
alkenen worden genoemd alsof het alkanen waren, maar het achtervoegsel”- ane “wordt gewijzigd in”- een”., Als het alkeen slechts één dubbele binding bevat en die dubbele binding terminaal is (de dubbele binding is aan het ene uiteinde van het molecuul of een ander uiteinde) dan is het niet nodig om een getal voor de naam te plaatsen.,
butaan: C4H10 (CH3CH2CH2CH3)
buteen: C4H8 (CH2=CHCH2CH3)
als de dubbele binding niet terminaal is (als deze zich op een koolstof ergens in het midden van de keten bevindt), moeten de koolstofatomen zo worden genummerd dat: geef de eerste van de twee dubbelgebonden koolstoffen het laagst mogelijke getal, en dat getal moet voorafgaan aan het achtervoegsel “ene” met een streepje, zoals hieronder weergegeven.,
correct: pent-2-een (CH3CH=CHCH2CH3)
onjuist: pent-3-een (CH3CH2CH=CHCH3)
De tweede is onjuist omdat het horizontaal omdraaien van de formule resulteert in een lager getal voor het alkeen.
indien er meer dan één dubbele binding in een alkeen is, moeten alle bindingen worden genummerd in de naam van het molecuul – zelfs terminale dubbele bindingen. De getallen moeten van laag naar hoog gaan en van elkaar gescheiden worden door een komma. De IUPAC numerieke voorvoegsels worden gebruikt om het aantal dubbele bindingen aan te geven.,
octa-2,4-dieen: CH3CH=CHCH=CHCH2CH2CH3
deca-1,5-dieen: CH2=CHCH2CH2CH=CHCH2CH2CH3
merk op dat de nummering van “2-4” hierboven een molecuul oplevert met twee dubbele bindingen gescheiden door enkel Eén enkele band. Dubbele bindingen in zo ‘ n toestand worden “geconjugeerd” genoemd, en ze vertegenwoordigen een verhoogde stabiliteit van conformatie, dus worden ze energetisch als reactanten in veel situaties en combinaties begunstigd.,
| alkaan | CnH2n+2 | dit is de maximale H/C-Verhouding voor een bepaald aantal koolstofatomen. | alkeen | CnH2n | elke dubbele binding vermindert het aantal waterstofatomen met 2. |
|---|
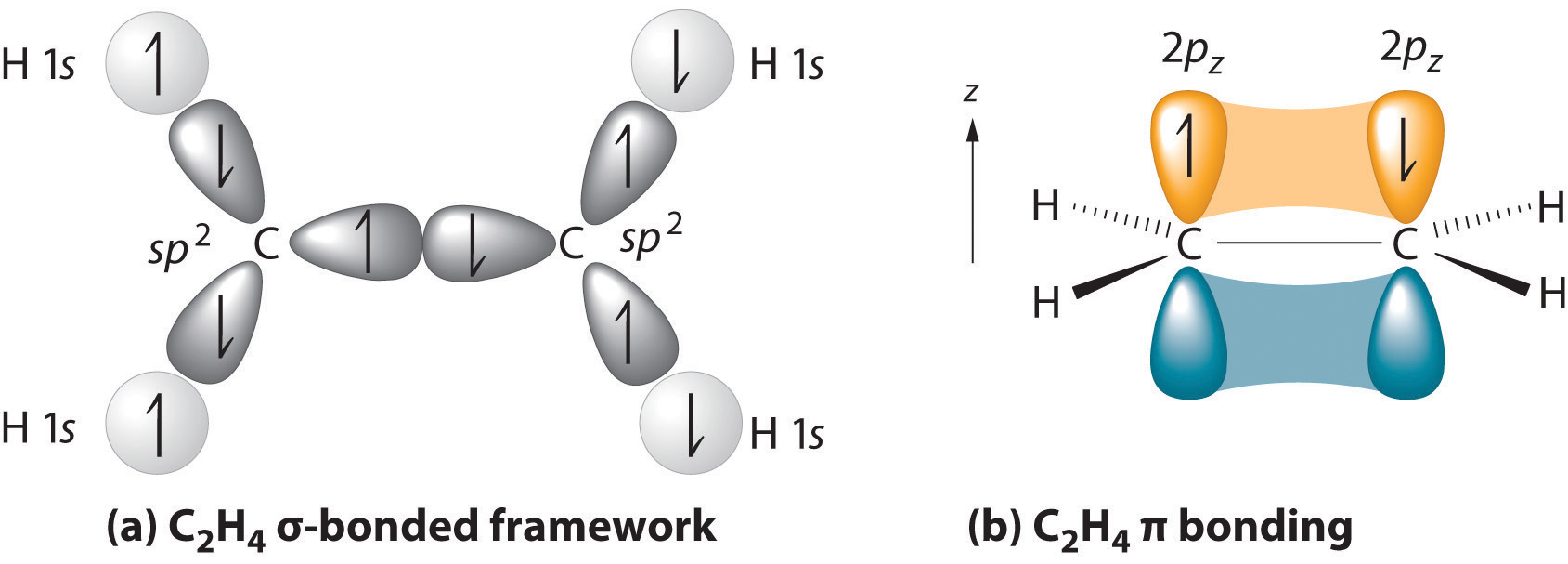
De ouderstructuur is de langste keten die beide koolstofatomen van de dubbele binding bevat., De twee koolstofatomen van de dubbele binding en de vier atomen die aan hen liggen in een vliegtuig, met de bond een hoek van ongeveer 120° Een dubbele binding bestaat uit een sigma bond gevormd door overlap van de sp2-hybride montuur en één pi-binding gevormd door overlapping van parallelle 2 p montuur
de molecuulformule van een koolwaterstof geeft informatie over de mogelijke structurele typen die deze kan vertegenwoordigen. Denk bijvoorbeeld aan verbindingen met de formule C5H8., De formule van de vijf-koolstofalkaan pentaan is C5H12 dus het verschil in waterstofgehalte is 4. Dit verschil suggereert dat dergelijke verbindingen een drievoudige binding, twee dubbele bindingen, een ring plus een dubbele binding, of twee ringen kunnen hebben. Enkele voorbeelden worden hier getoond, en er zijn minstens veertien andere!