tot nu toe hebben we gekeken naar de manieren waarop paren van atomaire orbitalen konden combineren om moleculaire orbitalen te vormen — om bindingen te vormen. Net zoals we denken aan een progressie van atomaire orbitalen van laagste energie naar hoogste (1s, 2s, 2p, 3s…), kunnen we deze moleculaire orbitalen organiseren in volgorde van hun energie.
de Orde van moleculaire orbitalen in energie kan voor een groot deel worden beschouwd als volgt uit de Orde van de atomaire orbitalen waaruit ze zijn opgebouwd., Er zijn een aantal afwijkingen van die regel, soms, maar dat is de eenvoudigste plek om te beginnen. In een molecuul zouden de moleculaire orbitalen met de laagste energie gevormd worden uit de atomaire orbitalen met de laagste energie, de 1s orbitalen.
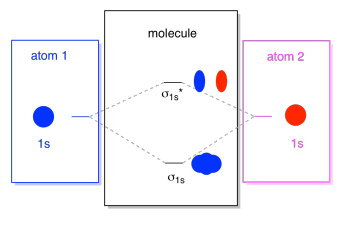
wat we hier zien is een moleculair orbitaal interactiediagram. Het midden van het diagram is gewoon het moleculaire orbitale energiediagram. Het is analoog aan het atomaire orbitale energiediagram (dat gaat 1s, 2s, 2p, 3s…). De Orde van energie tot nu toe is σ1s, σ1s*., De zijkanten van het diagram verwijzen gewoon terug naar waar die moleculaire orbitalen vandaan kwamen, met stippellijnen om je van de ene plaats naar de andere te leiden. Al met al zegt de afbeelding dat de 1s-baan op het ene atoom en de 1s-baan op het andere atoom op twee verschillende manieren kunnen combineren, waarbij de lagere energie wordt geproduceerd, σ1s wordt gebonden en de hogere energie, waardoor σ1s*wordt antibond.
merk op dat we nog geen elektronen hebben toegevoegd aan dat moleculaire orbitale energiediagram, maar als we dat doen, zullen we ze gewoon van onderaf invullen, net zoals we een atomair orbitale energiediagram zouden doen.,
De op één na laagste verzameling atomaire orbitalen is het 2s-niveau. Deze bolvormige orbitalen zouden heel erg op 1s orbitalen lijken, en we zouden een vergelijkbaar diagram krijgen, alleen op een iets hoger energieniveau.
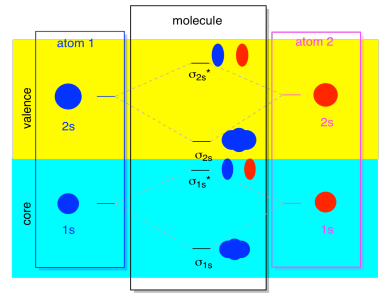
meestal zien we niet zowel de σ1s als de σ2s weergegeven in het diagram. Dat is omdat als er 2s elektronen zijn, dan zijn die 1s elektronen eigenlijk kernelektronen, niet valentie. Ze zitten wat dieper in het atoom en spelen geen belangrijke rol bij het binden., Het negeren van de kernelektronen is vrij gebruikelijk; als je je herinnert, in atomaire elektronenconfiguraties zouden we 2s22p4 kunnen schrijven in plaats van 1s22s22p4 voor zuurstof; we negeerden de kern. Toen we Lewis-structuren tekenden, gaven we zuurstof zes elektronen, in plaats van acht; we negeerden de kern.
in de context van MO, stel dat we 2s elektronen hebben. Dat moet betekenen dat elk atoom twee 1s elektronen van zijn eigen, voor een totaal van vier. Wanneer deze vier elektronen van onderaf in het MO-diagram worden ingevuld, zullen ze zowel de binding σ1s als de antibondende σ1s * innemen., Het effect van beide combinaties die bezet zijn, is het opheffen van de binding; deze twee paren elektronen blijven niet-binding. Dus we kunnen ze negeren en we missen niet echt iets.
de 2S orbitalen zijn niet de enige in de tweede shell. Er zijn ook 2P orbitalen. Vergeet niet dat er een aantal zeer verschillende manieren zijn waarop p-orbitalen met elkaar kunnen combineren, afhankelijk van welke As ze liggen. Als ze niet evenwijdig aan elkaar liggen-dat wil zeggen, als ze loodrecht op elkaar staan, zoals een px en een py-dan kunnen ze helemaal niet met elkaar communiceren., De pz op het ene atoom kan echter interageren met de pz op het andere atoom, omdat ze parallel aan elkaar zijn.
gewoonlijk definiëren we de Z-as als liggend langs de lijn tussen de twee atomen waar we naar kijken. Twee PZ-orbitalen zouden langs die as liggen, elk met een kwab die zich uitstrekt in de ruimte tussen de atomen, en elk met een andere kwab die zich uitstrekt in de andere richting
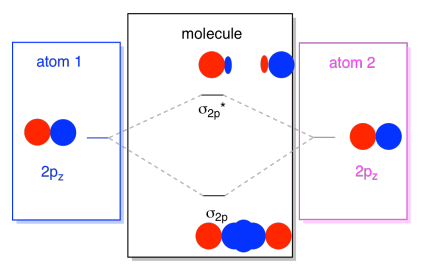
de resulterende combinaties worden σ genoemd omdat ze langs de as tussen de atomen liggen (dat is precies wat σ betekent, in termen van binding)., Er is een σ combinatie, als de overlappende kwabben in fase met elkaar zijn, en σ* combinatie, als die kwabben uit fase met elkaar zijn. Omdat deze nieuwe orbitalen voortkomen uit de atomaire 2P orbitalen, noemen we ze σ2p en σ2p*.
Er zijn ook die p-orbitalen die niet langs de bindingsas liggen, of de as tussen de twee atomen. De PX orbitalen staan loodrecht op de PZ orbitalen die we net bekeken hebben, en dus loodrecht op de as tussen de bindingen. Echter, ze zijn nog steeds parallel aan elkaar, en ze kunnen nog steeds combinaties vormen., Deze twee orbitalen zouden een in-fase combinatie en een out-of-fase combinatie vormen.
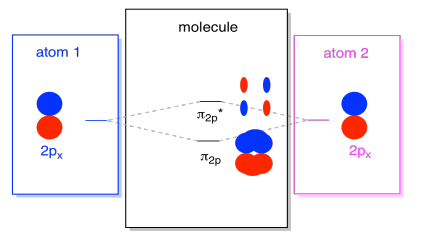
merk op dat de energetische scheiding tussen deze twee combinaties iets kleiner is dan de kloof tussen de σ2p en σ2p* niveaus. Het verschil is gerelateerd aan de mate van overlapping tussen de atomaire orbitalen. De on-as orbitalen projecteren sterk in dezelfde ruimte; ze overlappen veel en ze interageren sterk. De off-axis orbitalen borstel tegen elkaar, interactie minder sterk, en resulteert in kleinere energetische veranderingen., De kloof tussen de n2p orbitaal en n2p* orbitaal is daarom veel kleiner dan die tussen de σ2p en σ2p* orbitaal.
er zijn eigenlijk twee van die p-orbitalen buiten de as. Naast de PX set zouden we een py set hebben. Als de PX-verzameling zich in het vlak van het scherm bevindt, heeft de Py-verzameling een orbitaal die voor uit steekt en een verborgen achter. Niettemin zijn de combinaties tussen de twee py orbitalen precies hetzelfde als wat we zagen tussen de twee px orbitalen. Ze zijn gewoon gedraaid in een loodrecht vlak ten opzichte van de PX combinaties.,
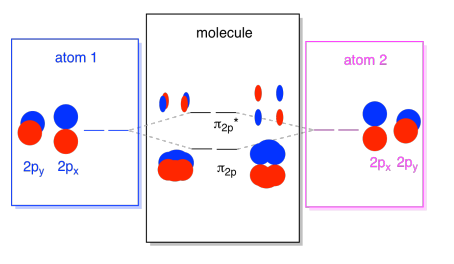
We kunnen al die 2P-gebaseerde orbitalen samenbrengen in één diagram. Het begint wat drukker te worden, maar dit diagram is slechts een combinatie van de stukken die we al gezien hebben. Merk op dat de PX, py en pz atomaire orbitalen allemaal beginnen met dezelfde energie (we hebben ze hier gestapeld zodat je nog steeds de correlatie tussen de atomaire en moleculaire orbitalen kunt zien). Dat betekent dat de n2p & n2p* orbitalen “genest” zullen worden tussen de σ2p & σ2p* orbitalen.,
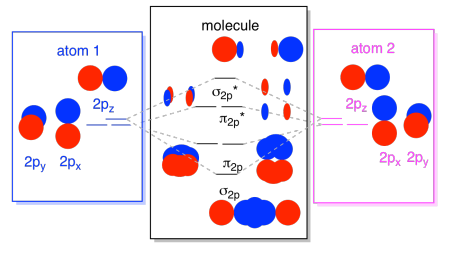
ten slotte, rekening houdend met het feit dat de 2P orbitalen hoger in energie zijn dan de 2s orbitalen, kunnen we deze afbeeldingen combineren in één diagram. Nogmaals, we hebben deze afzonderlijke stukken eerder gezien; we zijn ze nu aan het assembleren.
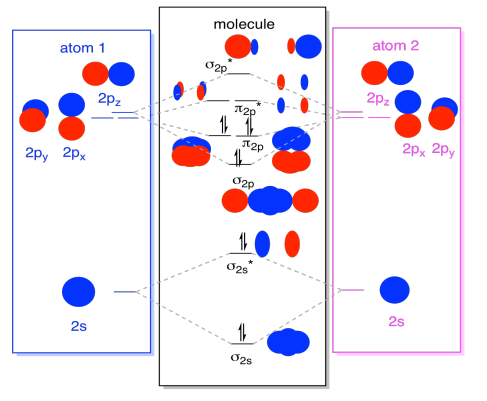
terwijl we bezig zijn, kunnen we de elektronen toevoegen. Hoe? Het is gewoon het totale aantal valentie-elektronen. We hebben bijvoorbeeld N2 gebruikt., Elke stikstof heeft vijf valentie-elektronen, voor een totaal van tien, dus we hebben net tien elektronen ingevuld, beginnend bij de bodem van het moleculaire orbitale energieniveau diagram. Als dit een ander molecuul was, zoals F2 of O2, zouden we het totale diagram op dezelfde manier construeren, maar gewoon een ander aantal elektronen gebruiken.
het orbitale plaatje dat we hierboven hebben beschreven is eigenlijk gewoon een potentieel plaatje van de elektronische structuur van dinitrogeen (en elke andere hoofdgroep of p-blok diatomair)., We krijgen geen echt beeld van de structuur van dinitrogen totdat we deze potentiële niveaus met elektronen bevolken.
- alleen de energieniveaus met elektronen hebben een effect op de energie (en het gedrag) van het molecuul.
met andere woorden, de energie van de elektronen bepaalt het gedrag van het molecuul. De andere energieniveaus zijn slechts mogelijkheden die onvervuld blijven.
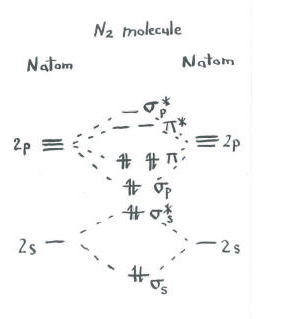
denk na over het beeld van dinitrogen.
- elke stikstof heeft vijf valentie-elektronen.
- Er zijn in totaal tien elektronen.,
- twee gaan elk naar de S S binding en S S* antibonding niveaus. Vergeet niet, we hielden deze gescheiden van de P set als een vereenvoudiging.
- twee gaan elk naar de S p binding en elk van de P binding niveaus.
de resterende orbitalen (S P * antibonding en elk van de P * antibonding niveaus) zijn onbezet. Dit zijn denkbeeldige niveaus die geen rol spelen bij het bepalen van de energie van dinitrogen. In een echte moleculaire orbitale berekening, zouden de elektronen in deze niveaus bijdragen aan de totale energie van het molecuul.,
we krijgen aanvullende informatie uit deze afbeelding. We kunnen bijvoorbeeld de bindingsvolgorde in dinitrogen zien.
- bindingsvolgorde is gewoon het aantal bindingen tussen een paar atomen.
- de bindingsorde is een van de verschillende factoren die de sterkte van de covalente binding beïnvloedt.
- hoe hoger de bindingsorde, hoe meer elektronen tussen de atomen worden gedeeld, en hoe sterker de binding.
in dinitrogen heffen de S S bindingen s s* antibonding niveaus elkaar op. Het ene paar is lager in energie dan het in het atoom was, maar het andere is hoger., Er is geen netto verlaging van de energie. Deze elektronen dragen niet bij aan een stikstof-stikstofbinding. Dit zijn niet-bindende elektronenparen.
de zes elektronen in de S p-binding en de P-binding niveaus vertegenwoordigen echter een afname van de energie van de energieniveaus in de vrije stikstofatomen. Deze drie, lage-energetische paren elektronen wijzen op drie bindingen tussen de stikstofatomen.
onthoud, we hebben een aantal korte-cuts gemaakt in deze afbeelding, en een echte moleculaire orbitale berekening zou iets verschillende resultaten kunnen geven., Niettemin zou het nog steeds een bindingsorde van zowel drie als twee niet-bindende elektronenparen onthullen.
bovendien worden moleculaire orbitale afbeeldingen soms op verschillende manieren getoond. Een moleculaire orbitale interactiediagram laat zien hoe atomaire of moleculaire orbitalen samenkomen om nieuwe orbitalen te maken. Soms zijn we alleen geïnteresseerd in de moleculaire orbitale energieniveaus zelf, en niet waar ze vandaan komen. Een moleculair orbitaal energieniveau diagram toont alleen de energieniveaus in het molecuul., Vaak, maar niet altijd, worden energiepeildiagrammen getoond zonder foto ‘ s van de orbitalen, om de aandacht te richten op de energieniveaus, die in wezen het belangrijkste deel van het beeld vormen. Bovendien, omdat alleen de bezette energieniveaus daadwerkelijk bijdragen aan de energie van het molecuul, worden soms de hogere energie, onbezette orbitalen buiten beeld gelaten.

zeer vaak versterken de resultaten van moleculaire orbitale berekeningen wat we zouden voorspellen van Lewis structuren., Als je een Lewis structuur van dinitrogen tekent, zul je ook een drievoudige stikstof-stikstof binding voorspellen. Het belangrijkste voordeel van de moleculaire orbitale theorie is dat het een kwantitatieve voorspelling van energie mogelijk maakt als we een echte berekening doen op een computer. Daarnaast is het belangrijk om te beseffen dat er geen echte reden is voor de octetregel tenzij we kwantummechanica overwegen. Lewis structuren zijn gebaseerd op een empirische observatie dat elektronen paren en octetten vormen, zonder te proberen te verklaren waarom., Moleculaire orbitale theorie neemt een aantal fundamentele relaties uit de fysica en past deze toe op zeer ingewikkelde moleculen met zeer goed succes. Alleen al door het aantal elektronen in het molecuul te kennen, en door ongeveer te weten waar de kernen zich in de structuur bevinden, geven moleculaire orbitale berekeningen zeer nuttige informatie over energie. Bovendien kunnen deze berekeningen in meer gecompliceerde gevallen dan N2 zelfs onze eerste gok over moleculaire geometrie en waar de bindingen zich bevinden corrigeren.,
oefening \(\Pagindex{2}\)
een moleculair orbitaal Diagram voor een diatomair molecuul (twee atomen) varieert in het aantal elektronen. Hoe bevolk je de elektronen?
antwoord
* tel de valentie-elektronen op het molecuul. Dat is het aantal valentie-elektronen op elk atoom, aangepast voor elke lading op het molecuul. (BV C22-heeft 10 valentie-elektronen: 4 van elke koolstof-dat is 8 – en twee meer voor de 2-lading).* vul eerst elektronen in de laagste energie orbitalen.* Paarelektronen nadat alle orbitalen op hetzelfde energieniveau één elektron hebben.,
oefening \(\Paginindex{3}\)
construeer een kwalitatief moleculair orbitaal diagram voor chloor, Cl2. Vergelijk de bindingsvolgorde met die in de Lewis-structuur (vergeet niet dat een elektron in een antibondende orbitaal de stabilisatie annuleert door binding van een elektron in een bindende orbitaal).
antwoord 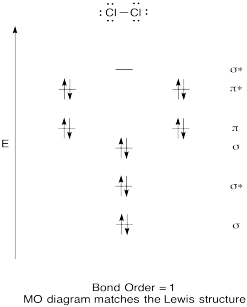
oefening \(\Paginindex{4}\)
- construeer een kwalitatief moleculair orbitaal diagram voor Zuurstof, O2.
- vergelijk de bindingsvolgorde met die in de Lewis-structuur.,
- Hoe verhoudt dit MO-beeld van zuurstof zich anders tot de Lewis-structuur? Wat vertellen de twee structuren je over elektronenparen?
- verbindingen waarvan al hun elektronen gekoppeld zijn, worden diamagnetisch genoemd. Degenen met ongepaarde elektronen worden aangeduid als paramagnetisch. Paramagnetische materialen worden aangetrokken door een magnetisch veld, maar diamagnetische dingen niet. Hoe verwacht je dat moleculaire zuurstof zich gedraagt?,
antwoord
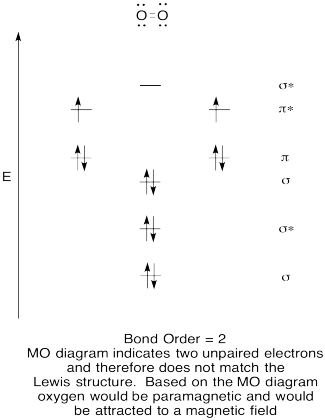
oefening \(\Paginindex{5}\)
- construeer een kwalitatieve moleculaire orbitaal diagram voor peroxide anion, O22-.
- vergelijk de bindingsvolgorde met die in de Lewis-structuur.
- Hoe verhoudt dit MO-beeld van zuurstof zich anders tot de Lewis-structuur? Wat vertellen de twee structuren je over elektronenparen?,
- op basis van moleculaire orbitale beelden, hoe gemakkelijk denk je dat dioxygen kan worden gereduceerd tot peroxide (door de toevoeging van twee elektronen)?
antwoord
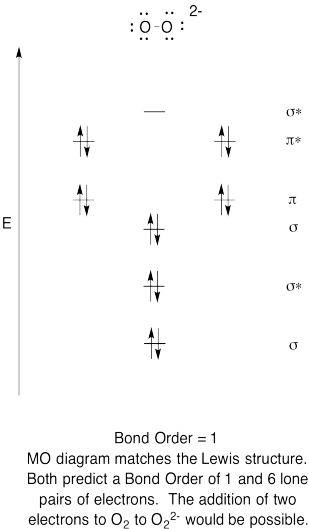
oefening \(\Paginindex{6}\)
construeer een kwalitatief moleculair orbitaal diagram voor diboor, B2. Denk je dat boor-boor bindingen zich gemakkelijk kunnen vormen, op basis van dit plaatje?,
antwoord
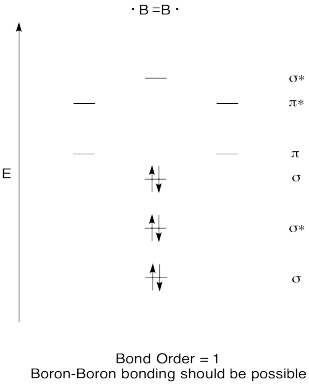
oefening \(\Paginindex{7}\)
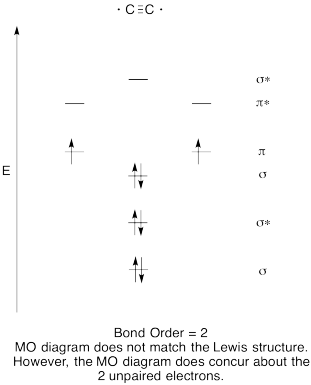
- construeer een kwalitatief moleculair orbitaal diagram voor dicarbon, C2.
- vergelijk de bindingsvolgorde met die in de Lewis-structuur.
- Hoe verhoudt dit MO-beeld van zuurstof zich anders tot de Lewis-structuur? Wat vertellen de twee structuren je over elektronenparen?,
antwoord
oefening \(\Paginindex{8}\)
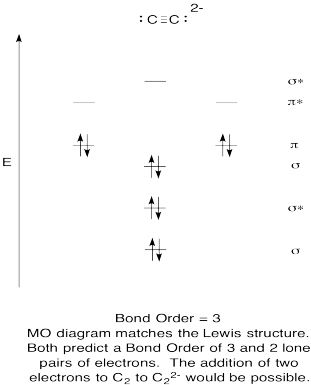
- construeer een kwalitatieve moleculaire orbitale diagram voor acetylide anion, C22-.
- vergelijk de bindingsvolgorde met die in de Lewis-structuur.
- Hoe verhoudt dit MO-beeld van zuurstof zich anders tot de Lewis-structuur? Wat vertellen de twee structuren je over elektronenparen?,
- op basis van moleculaire orbitale beelden, hoe gemakkelijk denk je dat dicarbon kan worden gereduceerd tot acetylide (door de toevoeging van twee elektronen)?
antwoord
oefening \(\Paginindex{9}\)
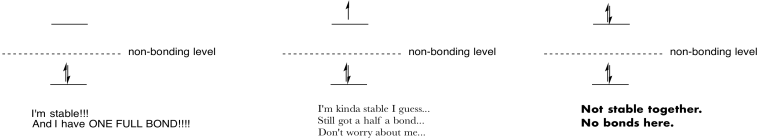
maak tekeningen en notities om het effect van het vullen van antibonding orbitalen samen te vatten.
antwoord
Attribution
Chris P Schaller, Ph. D.,, (College van Sint-Benedictus / Universiteit van Sint-Jan)