Lo studio della cinetica consente agli scienziati di determinare la relazione tra i cambiamenti delle condizioni e la velocità di una particolare reazione chimica. Uno dei fattori più importanti che influenzano la velocità di una reazione è la reattività delle sostanze chimiche coinvolte in quella specifica reazione; Inoltre, ci sono diverse variabili che possono anche influenzare la velocità di una reazione (concentrazione, temperatura, catalizzatore, ecc.).
Una di queste variabili è considerata una collisione.,
Ogni reazione chimica richiede collisioni tra le particelle reagenti (atomi e / o molecole). D’altra parte, non tutte le collisioni promuovono la reazione. Invece, se le particelle in collisione non hanno sufficiente energia cinetica o un corretto orientamento nello spazio, la reazione non si verificherà.
Ma cosa si intende per “energia sufficiente” o “orientamento corretto”? Per avere una migliore idea dei concetti menzionati in precedenza, l’articolo fornirà alcune definizioni generali accompagnate da esempi corrispondenti e problemi di esempio.,
Il nostro obiettivo principale è definire il concetto di energia di attivazione e spiegare perché alcune delle collisioni non provocano una reazione.
Di conseguenza, questo articolo si concentrerà principalmente sul concetto di collisione reattiva. Insieme a questo, vedremo brevemente alcuni scenari che coinvolgono collisioni non reattive. Poiché le collisioni sono associate a due caratteristiche principali, l’energia e l’orientamento spaziale, discuteremo anche questi termini.,
Teoria delle collisioni
Come abbiamo già detto sopra, le collisioni tra due o più molecole devono verificarsi affinché si verifichi una reazione chimica. Ma la collisione non è sufficiente per i reagenti da trasformare in prodotti. Le molecole devono avere abbastanza energia e devono scontrarsi con il corretto orientamento spaziale.
Come forse già sapete, esistono diversi tipi di reazioni, tra cui sintesi, decomposizione, spostamento e combustione., Considerando il fatto che la teoria delle collisioni si concentra sulle reazioni che coinvolgono le collisioni tra due specie, non devi preoccuparti molto delle reazioni di decomposizione poiché, in questi casi, un singolo composto è caduto a pezzi e non è necessario considerare le collisioni o l’orientamento delle particelle nello spazio.
In caso di reazioni che coinvolgono due specie, le collisioni tra le molecole sono cruciali per la reazione; ma solo le collisioni di molecole con sufficiente energia cinetica e orientamento spaziale rilevante possono causare una reazione., Pertanto, l’energia è necessaria per rompere i legami all’interno delle molecole reagenti, mentre l’orientamento delle molecole nello spazio gioca un ruolo importante nell’allineare gli atomi appropriati l’uno con l’altro per riformare i legami spezzati nel modo corretto.
Quando entrambi i criteri sono soddisfatti, la collisione viene considerata come una collisione riuscita, efficace o reattiva.
Considerando l’importanza dei due fattori sopra menzionati (energia e orientamento), dovremmo continuare l’ulteriore spiegazione dei termini e dei concetti per comprendere meglio i principi della teoria delle collisioni.,
Energia di attivazione
Come abbiamo già accennato in precedenza, le particelle devono scontrarsi con energia sufficiente perché si verifichi una reazione. Questa energia minima richiesta per la reazione di procedere è definita come l’energia di attivazione.,
Come forse sapete, ci sono due tipi di reazioni in materia di energia di rilascio o di assorbimento, che sono i seguenti:
- reazione Endotermica di energia è assorbito in una reazione (di solito in forma di calore)
- reazione Esotermica – energia liberata in una reazione (di solito in forma di calore)
A prima vista, potrebbe sembrare che, poiché l’energia viene liberata in una reazione esotermica, non ci dovrebbe essere alcun bisogno di inserire un po ‘ di energia per far avvenire la reazione. Al contrario, entrambe le reazioni chimiche endotermiche ed esotermiche richiedono energia per iniziare.,
Sembra un po ‘ strano, giusto? Perché una reazione ha bisogno dell’apporto di energia se l’energia viene conseguentemente rilasciata?
Consideriamo i seguenti esempi di reazioni esotermiche che si verificano nella nostra vita quotidiana.

Esempio #1 – la Combustione di una Candela
La combustione di una candela rilascia energia sotto forma di calore; di conseguenza, la reazione che si verificano durante il processo è esotermico. Ovviamente, è necessario accendere la candela usando un fiammifero o un accendino., Ciò significa che devi inserire un po ‘ di energia affinché la candela si accenda. Dopo di ciò, la reazione ha energia sufficiente per procedere ai passaggi successivi e la candela continua a bruciare energia.
Tuttavia, una candela non scoppierà mai in fiamme da sola, giusto?
Esempio #2-Accendere un fiammifero

Una tipica testa di fiammifero è composta da zolfo mescolato con diversi agenti ossidanti. Per accendere il fiammifero, si dovrebbe strofinare la testa partita contro il lato speciale di una scatola di fiammiferi., Durante questo processo, avviene una reazione e rilascia energia in forme di luce e calore. Pertanto, la reazione è considerata esotermica. Anche se, è ancora necessario inserire un po ‘ di energia per il fiammifero per iniziare a bruciare. Questa energia è definita tramite il termine “energia di attivazione.”Analogamente all’esempio precedente, finché fornisci energia sufficiente affinché il fiammifero si accenda, continuerà a bruciare e rilasciare calore da solo.
Il grafico dell’energia di attivazione descrive i cambiamenti di energia che si verificano durante una reazione chimica.,
Per tracciare l’energia di attivazione grafico, è fondamentale prendere in considerazione due variabili:
- Numero di collisioni tra molecole diverse
- energia Cinetica della collisione molecole
La prima variabile è abbastanza facile da capire dato che ha un significato diretto e definisce il numero di collisioni tra particelle di due specie al secondo.
La seconda variabile è l’energia cinetica delle molecole in collisione, che può essere definita come l’energia del movimento delle molecole.
- Reazione endotermica: l’energia viene assorbita., L’energia dei reagenti è inferiore all’energia dei prodotti.
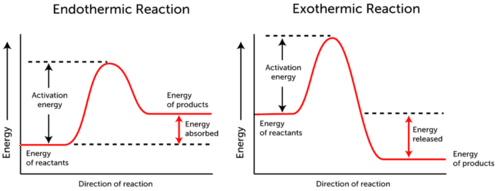
- Viene rilasciata energia di reazione esotermica. L’energia dei reagenti è più dell’energia dei prodotti.
Come puoi vedere nei due grafici sopra, l’energia di attivazione per entrambe le reazioni endotermiche ed esotermiche è la stessa.,
Poiché la reazione endotermica non può produrre quanta energia deve consumare per la reazione, l’energia viene assorbita; pertanto, l’energia dei prodotti è superiore all’energia dei reagenti.
Al contrario, le reazioni esotermiche producono più energia di quella che usano come energia di attivazione. Di conseguenza, l’energia viene rilasciata e i prodotti hanno un’energia inferiore rispetto ai reagenti.,
In conclusione, si può affermare che anche se le molecole reagenti si scontrano rapidamente tra loro, è essenziale che le molecole abbiano energia sufficiente per la reazione.
Orientamento spaziale
Secondo la teoria delle collisioni, non tutte le collisioni hanno successo, anche se le molecole reagenti hanno un’energia di attivazione sufficiente. Le molecole devono anche scontrarsi nel modo giusto.
Quindi, il secondo aspetto che influenza le collisioni reattive è considerato l’orientamento spaziale (orientamento delle molecole nello spazio).,
Cosa si intende per orientamento “corretto” delle molecole in una reazione?
Quando due molecole si scontrano, entrambe le molecole devono essere posizionate nel modo in cui è facile per loro reagire. Per comprendere appieno il concetto, è importante evidenziare il meccanismo della reazione.
si consideri la reazione tra propilene (o propilene) e bromuro di idrogeno, come per esempio:

Come si può vedere sopra, la reazione procede in 2 passaggi.,
Fase 1: il doppio legame è rotto
Fase 2: il bromo è attaccato
In questa reazione, gli orientamenti molecolari di HBr e C3H6 svolgono un ruolo importante poiché uno di essi era situato in un altro modo, non sarebbe stato possibile per l’atomo H avvicinarsi alla molecola di propilene.
Questo è vero per ogni reazione. Ogni molecola deve avere il corretto orientamento nello spazio affinché la reazione abbia luogo. Il corretto orientamento assicura che le molecole si trovino nel modo in cui è relativamente facile per loro scontrarsi e reagire.,
Possiamo concludere che l’orientamento favorevole delle molecole reagenti è essenziale quanto l’energia di attivazione sufficiente.
Sommario
Termini e i concetti definiti in tutto l’articolo sono riepilogati nella tabella di seguito riportata:
| Collisione Teoria | Spiega come le particelle devono interagire con gli altri per provocare una reazione., Secondo la Teoria delle Collisioni, devono essere soddisfatti due criteri affinché una reazione chimica abbia luogo: le molecole devono scontrarsi con energia di attivazione sufficiente per rompere e riformare i legami esistenti; le molecole devono scontrarsi con un orientamento spaziale favorevole. |
| Collisione riuscita (indicata anche come collisione efficace o reattiva) | Collisione di molecole con sufficiente energia di attivazione e corretto orientamento nello spazio che si traduce in una reazione chimica., |
| Energia di attivazione | L’energia minima necessaria per la reazione. L’apporto di energia è necessario in caso di reazioni endotermiche ed esotermiche. |
| Reazione endotermica | L’energia (calore) viene assorbita; L’energia dei reagenti è INFERIORE all’energia dei prodotti; Non può produrre tanta energia quanta consuma durante la reazione., |
| Reazione esotermica | L’energia (calore) viene rilasciata; L’energia dei reagenti è SUPERIORE all’energia dei prodotti; Può produrre più energia di quella che consuma durante la reazione. |
| Orientamento molecolare | Orientamento spaziale delle molecole., |
Three different scenarios are represented in the picture attached below:
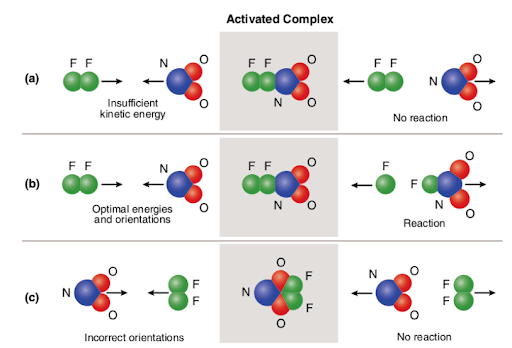
The picture summarizes the concept of collision theory utilizing two reactant molecules (fluorine (F2) and molecular nitrogen dioxide (NO2)) and three different cases to form nitrogen oxyfluoride.,
Nel caso di (a), le molecole reagenti hanno un corretto orientamento spaziale ma non hanno sufficiente energia di attivazione; Pertanto, la reazione non si verifica a causa del fatto che non c’è abbastanza energia per rompere i legami. Quindi, la collisione tra le due molecole è considerata non reattiva.
Nel caso di (b), le molecole reagenti hanno sia un’energia di attivazione sufficiente che un corretto orientamento nello spazio. A causa delle caratteristiche ottimali delle molecole, la reazione procede e si forma l’ossifluoruro di azoto., Quindi, la collisione tra le due molecole è considerata reattiva.
Nel caso di (c), le molecole reagenti hanno energia di attivazione sufficiente ma non sono correttamente situate nello spazio; Pertanto, la reazione non ha luogo poiché non è possibile che le molecole si raggiungano l’un l’altra nel modo in cui si rompono i legami. Quindi, analogamente al primo caso, la collisione tra le due molecole è considerata non reattiva.