Richard Baxter e Jim Britton
Come corrode l’acciaio nell’acqua?
Per comprendere la protezione catodica, è necessario prima capire come viene causata la corrosione. Affinché la corrosione si verifichi, devono essere presenti tre cose:
1. Due metalli dissimili
2. Un elettrolita (acqua con qualsiasi tipo di sale o sali disciolti in esso)
3., Un percorso metallico (conduttore) tra i metalli dissimili
I due metalli dissimili possono essere leghe totalmente diverse – come l’acciaio e l’alluminio – ma hanno maggiori probabilità di essere differenze metallurgiche microscopiche o macroscopiche sulla superficie di un singolo pezzo di acciaio. In questo caso considereremo l’acciaio corroso liberamente, che non è uniforme.
Se esistono le condizioni di cui sopra, la seguente reazione avviene nei siti più attivi: (due ioni di ferro più quattro elettroni liberi).,
2Fe => 2Fe++ + 4e –
Gli elettroni liberi viaggiano attraverso il percorso metallico verso i siti meno attivi, dove avviene la seguente reazione: (il gas ossigeno viene convertito in ion ossigeno – combinandosi con i quattro elettroni liberi-che si combina con l’acqua per formare ioni idrossile).
O2 + 4e- + 2H20 => 4 OH-
Le ricombinazioni di questi ioni sulla superficie attiva producono la seguente reazione, che produce il prodotto di corrosione del ferro idrossido ferroso: (ferro che si combina con ossigeno e acqua per formare idrossido ferroso).,
2Fe + O2 + 2H2O => 2Fe (OH)2
Questa reazione è più comunemente descritta come ” flusso di corrente attraverso l’acqua dall’anodo (sito più attivo) al catodo (sito meno attivo).’
In che modo la protezione catodica arresta la corrosione?
La protezione catodica previene la corrosione convertendo tutti i siti anodici (attivi) sulla superficie metallica in siti catodici (passivi) fornendo corrente elettrica (o elettroni liberi) da una fonte alternativa.
Di solito questo assume la forma di anodi galvanici, che sono più attivi dell’acciaio., Questa pratica viene anche definita un sistema sacrificale, poiché gli anodi galvanici si sacrificano per proteggere l’acciaio strutturale o la conduttura dalla corrosione.
Nel caso degli anodi di alluminio, la reazione sulla superficie di alluminio è 🙁 quattro ioni di alluminio più dodici elettroni liberi)
4Al = > 4AL+++ + 12 e –
e sulla superficie dell’acciaio: (gas ossigeno convertito in ioni ossigeno che si combinano con acqua per formare ioni idrossile).,
3O2 + 12e- + 6H20 => 12OH-
Finché la corrente (elettroni liberi) arriva al catodo (acciaio) più velocemente dell’ossigeno, non si verificherà alcuna corrosione.,
considerazioni di Base durante la progettazione di anodo sacrificale impianti
La corrente elettrica anodo scarichi è controllato dalla legge di Ohm, che è:
I=E/R
I= flusso di Corrente in ampere
E= Differenza di potenziale tra anodo e catodo in volt
R= resistenza Totale del circuito in ohm
Inizialmente, la corrente è elevato perché la differenza di potenziale tra anodo e catodo sono alti, ma come la differenza di potenziale diminuisce per effetto del flusso di corrente sul catodo, la corrente diminuisce gradualmente a causa della polarizzazione del catodo., La resistenza del circuito include sia il percorso dell’acqua che il percorso del metallo, che include qualsiasi cavo nel circuito. Il valore dominante qui è la resistenza dell’anodo all’acqua di mare.
Per la maggior parte delle applicazioni, la resistenza del metallo è così piccola rispetto alla resistenza all’acqua che può essere ignorata (anche se questo non è vero per slitte o lunghe condutture protette da entrambe le estremità). In generale, gli anodi lunghi e sottili hanno una resistenza inferiore rispetto agli anodi corti e grassi. Scaricheranno più corrente ma non dureranno più a lungo.,
Pertanto, un progettista di protezione catodica deve dimensionare gli anodi in modo che abbiano la giusta forma e superficie per scaricare abbastanza corrente per proteggere la struttura e abbastanza peso per durare la vita desiderata quando si scarica questa corrente.
Come regola generale:
La lunghezza dell’anodo determina quanta corrente può produrre l’anodo e, di conseguenza, quanti piedi quadrati di acciaio possono essere protetti. La sezione trasversale (peso) determina per quanto tempo l’anodo può sostenere questo livello di protezione.,
Sistemi di protezione catodica a corrente impressionata (anp anode systems)
A causa delle elevate correnti coinvolte in molti sistemi di acqua di mare, non è raro utilizzare sistemi a corrente impressionata che utilizzano anodi di un tipo (anodi ICp) che non sono facilmente disciolti in ioni metallici. Ciò provoca una reazione alternativa: l’ossidazione degli ioni cloruro disciolti.
2cl – => Cl2 + 2e-
L’alimentazione viene fornita da un’unità di alimentazione CC esterna.,

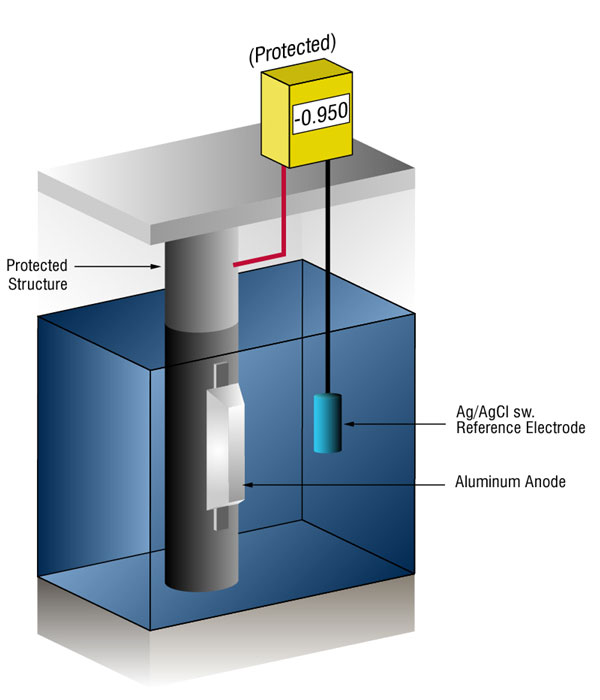
Come facciamo a sapere quando abbiamo abbastanza protezione catodica?
Possiamo verificare che ci sia abbastanza corrente misurando il potenziale dell’acciaio contro un elettrodo di riferimento standard, solitamente argento argento/cloruro (Ag/AgCl sw.), ma a volte zinco (sw.).
Il flusso di corrente su qualsiasi metallo sposterà il suo potenziale normale nella direzione negativa. La storia ha dimostrato che se l’acciaio riceve abbastanza corrente per spostare il potenziale a ( – ) 0.800 V vs., silver / silver chloride (Ag / AgCl), the corrosion is essentially stopped.
 |
 |