Categoria: Chimica
Pubblicato: dicembre 9, 2013
Sì, l’acqua può rimanere liquida sotto zero gradi Celsius. Ci sono alcuni modi in cui questo può accadere.
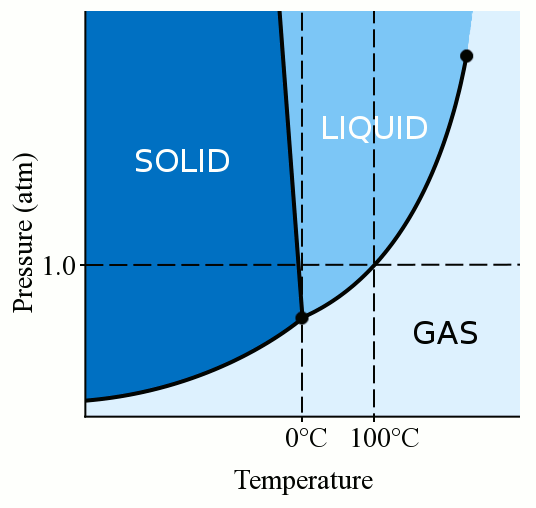
Prima di tutto, la fase di un materiale (che sia gas, liquido o solido) dipende fortemente sia dalla sua temperatura che dalla sua pressione., Per la maggior parte dei liquidi, l’applicazione della pressione aumenta la temperatura alla quale il liquido si congela in solido. Un solido si forma quando le molecole sciolte e serpeggianti di un liquido diventano abbastanza lente e abbastanza vicine da formare legami stabili che le fissano in posizione. Quando applichiamo pressione a un liquido, costringiamo le molecole ad avvicinarsi. Possono quindi formare legami stabili e diventare solidi anche se hanno una temperatura superiore al punto di congelamento a pressione standard. L’acqua è un po ‘ unica, però. Le molecole d’acqua si diffondono quando si legano in una solida struttura cristallina., Questa azione di diffusione porta il ghiaccio ad essere meno denso dell’acqua liquida, causando il galleggiamento del ghiaccio. Questa azione di diffusione delle molecole d’acqua durante il congelamento significa anche che l’applicazione di pressione all’acqua abbassa il punto di congelamento. Se si applica una pressione sufficiente (rendendo difficile la diffusione delle molecole d’acqua nella struttura solida), è possibile avere acqua liquida diversi gradi sotto zero gradi Celsius.
Anche se non si applica pressione, è comunque possibile avere acqua liquida a temperature sotto lo zero utilizzando additivi., Additivi come il sale possono interferire con il legame chimico necessario per formare un solido e quindi possono abbassare il punto di congelamento dell’acqua. Il sale è composto da forti ioni di sodio e cloro. Quando disciolte in acqua, le molecole d’acqua tendono ad attaccarsi agli ioni di sale invece che l’una all’altra, e quindi non si congelano facilmente. Come si aggiunge più sale all’acqua, il suo punto di congelamento continua a cadere fino a quando l’acqua raggiunge la saturazione e non può contenere più sale. Se si aggiunge abbastanza sale, il punto di congelamento dell’acqua può essere lasciato cadere fino a -21 gradi Celsius., Questo fatto significa che l’acqua a -21 gradi Celsius può ancora rimanere liquida se viene aggiunto abbastanza sale. Invece di mantenere l’acqua liquida dal congelamento, questa potente proprietà del sale può anche essere utilizzata per trasformare il ghiaccio in acqua. Cospargere di sale sui marciapiedi ghiacciati abbassa il punto di congelamento del ghiaccio al di sotto della temperatura ambiente e il ghiaccio si scioglie. Ma cospargere di sale sulle passerelle ghiacciate non aiuterà se la temperatura ambiente è inferiore a -21 gradi Celsius. L’effetto del sale sul punto di congelamento dell’acqua ha anche profondi effetti sugli oceani della terra.,
Anche se non si applica pressione e non si aggiunge nulla all’acqua, è comunque possibile avere acqua liquida a temperature inferiori a zero gradi Celsius. Affinché l’acqua si congeli sul ghiaccio, ha bisogno di qualcosa su cui congelarsi per avviare il processo. Chiamiamo questi punti di partenza “centri di nucleazione”. Nella maggior parte delle situazioni, un po ‘ di polvere, impurità o anche piccole vibrazioni nell’acqua forniscono centri di nucleazione per congelare l’acqua. Ma se la tua acqua è molto pura e molto immobile, non c’è nulla su cui cristallizzare le molecole d’acqua., Di conseguenza, è possibile raffreddare l’acqua molto pura ben al di sotto dello zero gradi Celsius senza congelarla. L’acqua in questa condizione è chiamata “supercooled”. A pressione standard, l’acqua pura può essere raffreddata fino a circa -40 gradi Celsius. L’acqua super raffreddata viene mantenuta dal congelamento solo dalla mancanza di centri di nucleazione. Pertanto, una volta forniti i centri di nucleazione (che potrebbero essere semplici come una vibrazione), l’acqua super raffreddata si congela rapidamente. La pioggia congelante è un esempio naturale di acqua liquida super raffreddata., Una volta che la pioggia gelata colpisce un oggetto sulla superficie terrestre, quell’oggetto fornisce centri di nucleazione e la pioggia si congela in ghiaccio.
Argomenti: congelamento, punto di congelamento, pioggia di congelamento, ghiaccio, diagramma di fase, pressione, sottoraffreddato, temperatura, acqua