Obiettivi di apprendimento
- Per acquisire una comprensione della teoria delle collisioni.
- Per ottenere una comprensione dei quattro fattori principali che influenzano la velocità di reazione.
La cinetica di reazione è lo studio della velocità delle reazioni chimiche e la velocità di reazione può variare notevolmente su una vasta gamma di scale temporali. Alcune reazioni possono procedere a velocità esplosive come la detonazione di fuochi d’artificio (Figura 17.,1 “Fuochi d’artificio di notte sul fiume”), mentre altri possono verificarsi a un ritmo lento per molti anni come la ruggine del filo spinato esposto agli elementi (Figura 17.2 “Filo spinato arrugginito”).
Figura 17.1. Fuochi d’artificio di notte sul fiume

La reazione chimica nei fuochi d’artificio avviene ad una velocità esplosiva.
Figura 17.2. Filo spinato arrugginito

La ruggine del filo spinato si verifica per molti anni.,
Teoria delle collisioni
Per comprendere la cinetica delle reazioni chimiche e i fattori che influenzano la cinetica, dovremmo prima esaminare cosa succede durante una reazione a livello molecolare. Secondo la teoria di collisione della reattività, le reazioni si verificano quando le molecole reagenti “si scontrano efficacemente.”Affinché si verifichi una “collisione efficace”, le molecole reagenti devono essere orientate correttamente nello spazio per facilitare la rottura e la formazione di legami e il riarrangiamento degli atomi che portano alla formazione di molecole prodotto (Figura 17.3″Visualizzazioni di collisione”).
Figura 17.3., Visualizzazioni di collisione
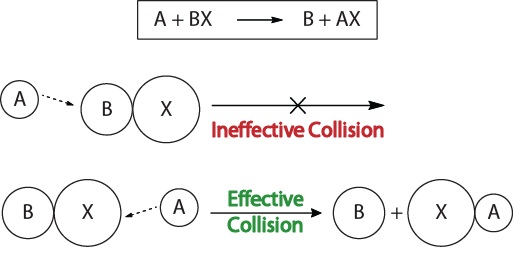
Questa visualizzazione mostra una collisione inefficace ed efficace basata sull’orientamento molecolare.
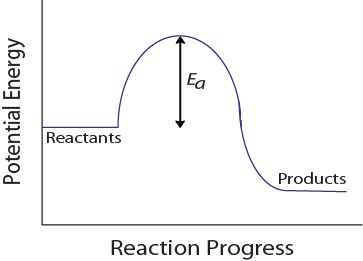
Durante una collisione molecolare, le molecole devono anche possedere una quantità minima di energia cinetica affinché si verifichi una collisione efficace. Questa energia varia per ogni reazione ed è nota come energia di attivazione (Ea) (Figura 17.4 “Energia potenziale ed energia di attivazione”)., La velocità di reazione dipende quindi dall’energia di attivazione; una maggiore energia di attivazione significa che meno molecole avranno energia sufficiente per subire una collisione efficace.
Figura 17.4. Energia potenziale ed energia di attivazione
Fattori che influenzano la velocità
Ci sono quattro fattori principali che possono influenzare la velocità di reazione di una reazione chimica:
1. Concentrazione di reagente., Aumentando la concentrazione di uno o più reagenti spesso aumenta la velocità di reazione. Ciò si verifica perché una maggiore concentrazione di un reagente porterà a più collisioni di quel reagente in un periodo di tempo specifico.
2. Stato fisico dei reagenti e superficie. Se le molecole reagenti esistono in diverse fasi, come in una miscela eterogenea, la velocità di reazione sarà limitata dall’area superficiale delle fasi che sono in contatto., Ad esempio, se un reagente metallico solido e un reagente gassoso sono mescolati, solo le molecole presenti sulla superficie del metallo sono in grado di scontrarsi con le molecole di gas. Pertanto, aumentando la superficie del metallo martellandolo piatto o tagliandolo in molti pezzi aumenterà la sua velocità di reazione.
3. Temperatura. Un aumento della temperatura aumenta tipicamente la velocità di reazione. Un aumento della temperatura aumenterà l’energia cinetica media delle molecole reagenti., Pertanto, una percentuale maggiore di molecole avrà l’energia minima necessaria per una collisione efficace (Figura. 17.5 “Temperatura e velocità di reazione”).
Figura. 17.5 Temperatura e velocità di reazione
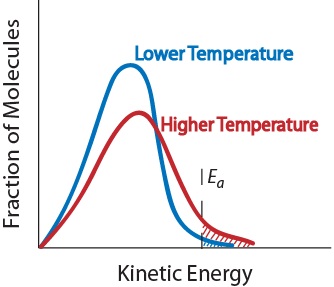
4. Presenza di un catalizzatore. Un catalizzatore è una sostanza che accelera una reazione partecipandovi senza essere consumata. I catalizzatori forniscono un percorso di reazione alternativo per ottenere prodotti., Sono fondamentali per molte reazioni biochimiche. Saranno esaminati ulteriormente nella sezione ” Catalisi.”
Key Takeaways
- Le reazioni si verificano quando due molecole reagenti si scontrano efficacemente, ognuna con energia minima e orientamento corretto.
- La concentrazione del reagente, lo stato fisico dei reagenti e l’area superficiale, la temperatura e la presenza di un catalizzatore sono i quattro fattori principali che influenzano la velocità di reazione.