10.2 Brønsted-Lowry Definizione di acidi e basi
Obiettivi formativi
- Riconoscere un composto come un acido di Brønsted-Lowry o una base di Brønsted-Lowry.
- Illustrare il processo di trasferimento di protoni che definisce una reazione acido-base di Brønsted-Lowry.
L’ammoniaca (NH3) aumenta la concentrazione di ioni idrossido in soluzione acquosa reagendo con acqua anziché rilasciando direttamente ioni idrossido., Infatti, le definizioni Arrhenius di un acido e una base si concentrano su ioni idrogeno e ioni idrossido. Esistono definizioni più fondamentali per acidi e basi?
Nel 1923, lo scienziato danese Johannes Brønsted e lo scienziato inglese Thomas Lowry proposero in modo indipendente nuove definizioni per acidi e basi. Piuttosto che considerare entrambi gli ioni idrogeno e idrossido, si sono concentrati solo sullo hydrogen idrogeno. Un composto acido di Brønsted-Lowry che fornisce uno hydrogen idrogeno (H+) in una reazione; un donatore di protoni. è un composto che fornisce uno hydrogen idrogeno in una reazione., Una base di Brønsted-Lowryun composto che accetta uno hydrogen idrogeno (H+) in una reazione; un accettore di protoni., al contrario, è un composto che accetta uno hydrogen idrogeno in una reazione. Pertanto, le definizioni di Brønsted-Lowry di un acido e di una base si concentrano sul movimento degli ioni idrogeno in una reazione, piuttosto che sulla produzione di ioni idrogeno e ioni idrossido in una soluzione acquosa.
Usiamo la reazione dell’ammoniaca nell’acqua per dimostrare le definizioni di Brønsted-Lowry di un acido e di una base., L’ammoniaca e le molecole d’acqua sono reagenti, mentre lo ammonium ammonio e lo hydroxide idrossido sono prodotti:
NH3(aq) + H2O(ℓ) → NH4+(aq) + OH−(aq)
Quello che è successo in questa reazione è che la molecola d’acqua originale ha donato uno hydrogen idrogeno alla molecola di ammoniaca originale, che a sua volta ha accettato lo hydrogen idrogeno. Possiamo illustrare questo come segue:
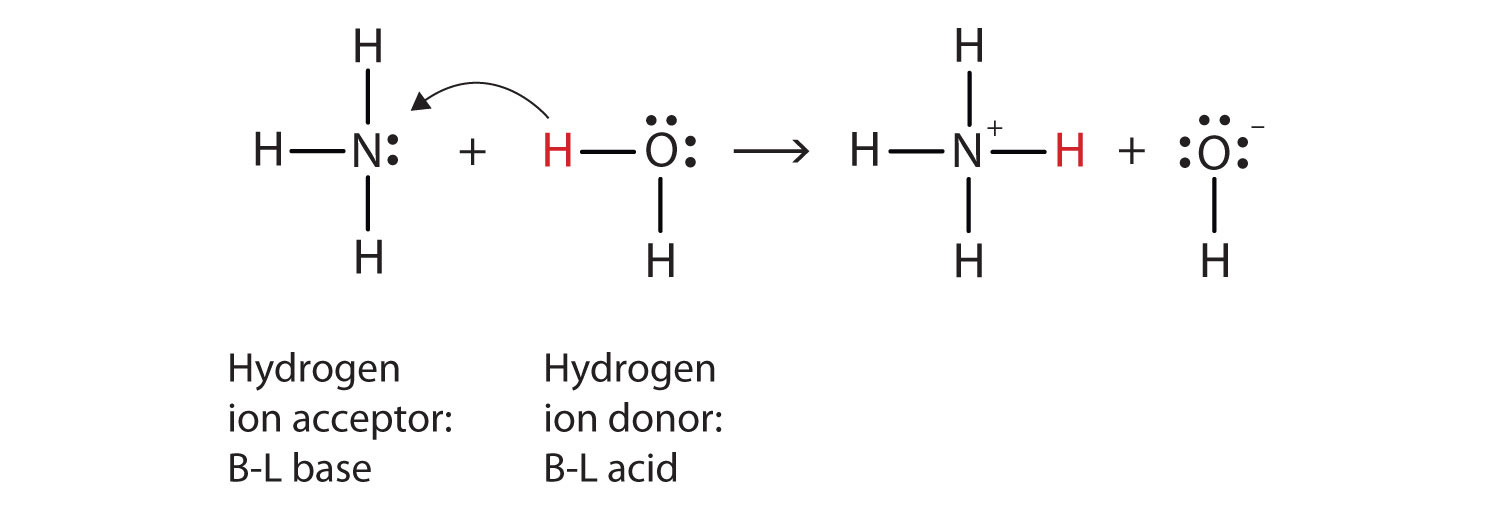
Poiché la molecola d’acqua dona uno hydrogen idrogeno all’ammoniaca, è l’acido di Brønsted-Lowry, mentre la molecola di ammoniaca—che accetta lo hydrogen idrogeno—è la base di Brønsted-Lowry., Pertanto, l’ammoniaca agisce come base sia nel senso di Arrhenius che nel senso di Brønsted-Lowry.
Un acido Arrhenius come l’acido cloridrico è ancora un acido nel senso di Brønsted-Lowry? Sì, ma ci richiede di capire cosa succede veramente quando l’HCl viene sciolto in acqua. Ricordiamo che l’atomo di idrogeno è un singolo protone circondato da un singolo elettrone. Per rendere lo hydrogen idrogeno, rimuoviamo l’elettrone, lasciando un protone nudo. Abbiamo davvero protoni nudi che galleggiano in soluzione acquosa? No, non lo sappiamo., Quello che succede davvero è che lo ion H + si attacca a H2O per creare H3O+, che è chiamato ion idronio. Per la maggior parte degli scopi, H + e H3O + rappresentano la stessa specie, ma scrivere H3O+ invece di H+ mostra che capiamo che non ci sono protoni nudi che galleggiano in soluzione. Piuttosto, questi protoni sono effettivamente attaccati a molecole di solvente.
Nota
Un protone in soluzione acquosa può essere circondato da più di una molecola d’acqua, portando a formule come H5O2+ o H9O4+ piuttosto che H3O+. È più semplice, tuttavia, utilizzare H3O+.,
Con questo in mente, come definiamo HCl come un acido nel senso di Brønsted-Lowry? Considera cosa succede quando HCl è disciolto in H2O:
HCl + H2O(ℓ) → H3O+(aq) + Cl−(aq)
Possiamo descrivere questo processo usando i diagrammi a punti di Lewis electron:
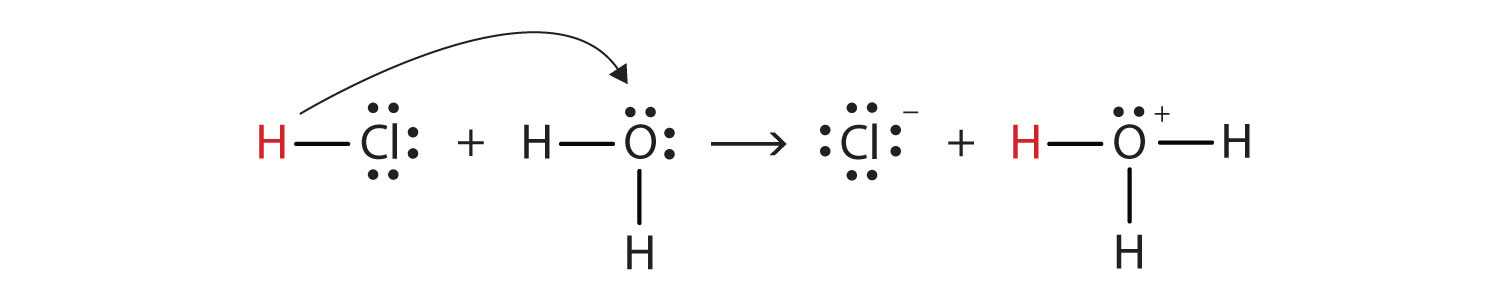
Ora vediamo che uno hydrogen idrogeno viene trasferito dalla molecola HCl alla molecola H2O per produrre ioni cloruro e ioni idronio. Come donatore di ioni idrogeno, l’HCl agisce come un acido di Brønsted-Lowry; come accettore di ioni idrogeno, H2O è una base di Brønsted-Lowry., Quindi l’HCl è un acido non solo nel senso di Arrhenius ma anche nel senso di Brønsted-Lowry. Inoltre, secondo le definizioni di Brønsted-Lowry, H2O è una base nella formazione di HCl acquoso. Quindi le definizioni di Brønsted-Lowry di un acido e una base classificano la dissoluzione dell’HCl in acqua come reazione tra un acido e una base—sebbene la definizione di Arrhenius non avrebbe etichettato H2O una base in questa circostanza.
Nota
Tutti gli acidi e le basi di Arrhenius sono acidi e basi di Brønsted-Lowry. Ma non tutti gli acidi e le basi di Brønsted-Lowry sono acidi e basi di Arrhenius.,
Esempio 3
L’anilina (C6H5NH2) è leggermente solubile in acqua. Ha un atomo di azoto che può accettare uno hydrogen idrogeno da una molecola d’acqua proprio come l’atomo di azoto in ammoniaca fa. Scrivi l’equazione chimica per questa reazione e identifica l’acido e la base di Brønsted-Lowry.
Soluzione
C6H5NH2 e H2O sono i reagenti. Quando C6H5NH2 accetta un protone da H2O, guadagna un H extra e una carica positiva e lascia un OH-ion dietro., La reazione è la seguente:
C6H5NH2(aq) + H2O(ℓ) → C6H5NH3+(aq) + OH−(aq)
Poiché C6H5NH2 accetta un protone, è la base di Brønsted-Lowry. La molecola H2O, perché dona un protone, è l’acido di Brønsted-Lowry.
Esercizio di abilità
-
La caffeina (C8H10N4O2) è uno stimolante trovato in caffè e tè. Quando disciolto in acqua, può accettare un protone da una molecola d’acqua. Scrivi l’equazione chimica per questo processo e identifica l’acido e la base di Brønsted-Lowry.,
Le definizioni di Brønsted-Lowry di un acido e di una base possono essere applicate alle reazioni chimiche che si verificano in solventi diversi dall’acqua. L’esempio seguente illustra.
Esempio 4
L’ammide di sodio (NaNH2) si dissolve in metanolo (CH3OH) e si separa in ioni sodio e ioni ammide (NH2−). Gli ioni ammidici reagiscono con il metanolo per produrre ammoniaca e lo meth metossido (CH3O−). Scrivi un’equazione chimica bilanciata per questo processo e identifica l’acido e la base di Brønsted-Lowry.,
Soluzione
L’equazione della reazione tra NH2− e CH3OH per rendere NH3 e CH3O− è come indicato di seguito:
NH2−(solv) + CH3OH(ℓ) → NH3(solv) + CH3O−(solv)
L’etichetta (solv) indica che le specie sono disciolti in un solvente, in contrasto (aq), che specifica acquosa (H2O) soluzione. In questa reazione, vediamo che lo ion NH2 accetta un protone da una molecola CH3OH per creare una molecola NH3. Quindi, come accettore di protoni, NH2-è la base di Brønsted-Lowry. Come donatore di protoni, CH3OH è l’acido di Brønsted-Lowry.,
Esercizio di abilità
-
Il cloruro di piridinio (C5H5NHCl) si dissolve in etanolo (C2H5OH) e si separa in ioni piridinio (C5H5NH+) e ioni cloruro. Lo py piridinio può trasferire uno hydrogen idrogeno a una molecola di solvente. Scrivi un’equazione chimica bilanciata per questo processo e identifica l’acido e la base di Brønsted-Lowry.
Per la salute: Reazioni acido-base di Brønsted-Lowry nei prodotti farmaceutici
Ci sono molte applicazioni interessanti delle reazioni acido-base di Brønsted-Lowry nell’industria farmaceutica., Ad esempio, i farmaci spesso devono essere solubili in acqua per la massima efficacia. Tuttavia, molti composti organici complessi non sono solubili o sono solo leggermente solubili in acqua. Fortunatamente, quei farmaci che contengono atomi di azoto che accettano protoni (e ce ne sono molti) possono essere fatti reagire con acido cloridrico diluito . Gli atomi di azoto-agendo come basi di Brønsted-Lowry-accettano gli ioni idrogeno dall’acido per formare uno ion, che di solito è molto più solubile in acqua., Le molecole di farmaco modificate possono quindi essere isolate come sali di cloruro:
RN ( sl aq)+H+(aq) → RNH + (aq) →Cl−(aq) RNHCl(s)
dove RN rappresenta un composto organico contenente azoto. L’etichetta (sl aq) significa “leggermente acquosa”, indicando che il composto RN è solo leggermente solubile. I farmaci che vengono modificati in questo modo sono chiamati sali di cloridrato. Gli esempi includono la codeina potente dell’antidolorifico, che è amministrata comunemente come cloridrato della codeina. Vengono utilizzati anche acidi diversi dall’acido cloridrico. L’acido bromidrico, ad esempio, fornisce sali di bromuro., Il destrometorfano, un ingrediente di molti farmaci per la tosse, è dispensato come bromidrato di destrometorfano. La figura di accompagnamento mostra un altro farmaco come sale cloridrato.
Il nome di questo medicinale chiarisce che esiste come sale cloridrato.
© Thinkstock
Esercizio di revisione del concetto
-
Dare le definizioni di un acido di Brønsted-Lowry e di una base di Brønsted-Lowry.,
Risposta
-
un acido di Brønsted-Lowry è un donatore di protoni, mentre una base di Brønsted-Lowry è un accettore di protoni.
Key Takeaways
- un acido di Brønsted-Lowry è un donatore di protoni e una base di Brønsted-Lowry è un accettore di protoni.
- Le reazioni acido-base di Brønsted-Lowry sono essenzialmente reazioni di trasferimento di protoni.
Esercizi
-
Etichettare ogni reattivo come un acido di Brønsted-Lowry o una base di Brønsted-Lowry.,
HCl (aq) + NH3(AQ) → NH4 + (AQ) + Cl−(AQ)
-
Etichettare ogni reattivo come un acido di Brønsted-Lowry o una base di Brønsted-Lowry.
H2O(ℓ)+N2H4(AQ) → N2H5 + (aq) + OH−(AQ)
-
Spiega perché un acido di Brønsted-Lowry può essere chiamato donatore di protoni.
-
Spiega perché una base di Brønsted-Lowry può essere chiamata accettore di protoni.
-
Scrivi l’equazione chimica della reazione dell’ammoniaca nell’acqua ed etichetta l’acido e la base di Brønsted-Lowry.,
-
Scrivi l’equazione chimica della reazione della metilammina (CH3NH2) in acqua ed etichetta l’acido e la base di Brønsted-Lowry.
-
Dimostrare che la dissoluzione di HNO3 in acqua è in realtà una reazione acido-base di Brønsted-Lowry descrivendola con un’equazione chimica ed etichettando l’acido e la base di Brønsted-Lowry.,
-
Identificare il Brønsted-Lowry acido e di base nel seguente equazione chimica:
C3H7NH2(aq) + H3O+(aq) → C3H7NH3+(aq) + H2O(ℓ)
-
Scrivi l’equazione chimica della reazione che si verifica quando la cocaina cloridrato (C17H22ClNO4) si scioglie in acqua e dona un protone ad una molecola di acqua. (Quando gli idrocloruri si dissolvono in acqua, si separano in ioni cloruro e nel catione appropriato.)
-
Se l’idrobromuro di codeina ha la formula C18H22BrNO3, qual è la formula del composto genitore codeina?,