Introduzione
Gli alcheni e gli alchini sono idrocarburi che hanno rispettivamente un doppio legame carbonio-carbonio e un triplo legame carbonio-carbonio. Le formule molecolari di questi idrocarburi insaturi riflettono il legame multiplo dei gruppi funzionali:
Gli alcheni sono chiamati come se fossero alcani, ma il suffisso “-ane” è cambiato in “-en”., Se l’alchene contiene solo un doppio legame e quel doppio legame è terminale (il doppio legame è ad un’estremità della molecola o all’altra), non è necessario posizionare alcun numero davanti al nome.,
butano: C4H10 (CH3CH2CH2CH3)
butene: C4H8 (CH2=CHCH2CH3)
Se il doppio legame non è terminale (se è in carbonio da qualche parte al centro della catena) quindi gli atomi di carbonio devono essere numerate in modo da dare il primo dei due atomi di carbonio legati il minor numero possibile, e che il numero è preceduto da un “ene” suffisso con un trattino, come mostrato di seguito.,
corretto: pent-2-en (CH3CH=CHCH2CH3)
errato: pent-3-en (CH3CH2CH=CHCH3)
Il secondo non è corretto perché ruotando orizzontalmente la formula si ottiene un numero inferiore per l’alchene.
Se c’è più di un doppio legame in un alchene, tutti i legami dovrebbero essere numerati nel nome della molecola – anche i doppi legami terminali. I numeri dovrebbero andare dal più basso al più alto ed essere separati l’uno dall’altro da una virgola. I prefissi numerici IUPAC sono usati per indicare il numero di doppi legami.,
octa-2,4-diene: CH3CH=CHCH=CHCH2CH2CH3
deca-1,5-diene: CH2=CHCH2CH2CH=CHCH2CH2CH3
Si noti che la numerazione di “2-4” sopra produce una molecola con due doppi legami separati da un solo singolo legame. I doppi legami in tale condizione sono chiamati “coniugati” e rappresentano una maggiore stabilità di conformazione, quindi sono favoriti energeticamente come reagenti in molte situazioni e combinazioni.,
| Alcano | CnH2n+2 | Questo è il rapporto massimo H / C per un dato numero di atomi di carbonio. |
|---|---|---|
| Alchene | CnH2n | Ogni doppio legame riduce il numero di atomi di idrogeno di 2. |
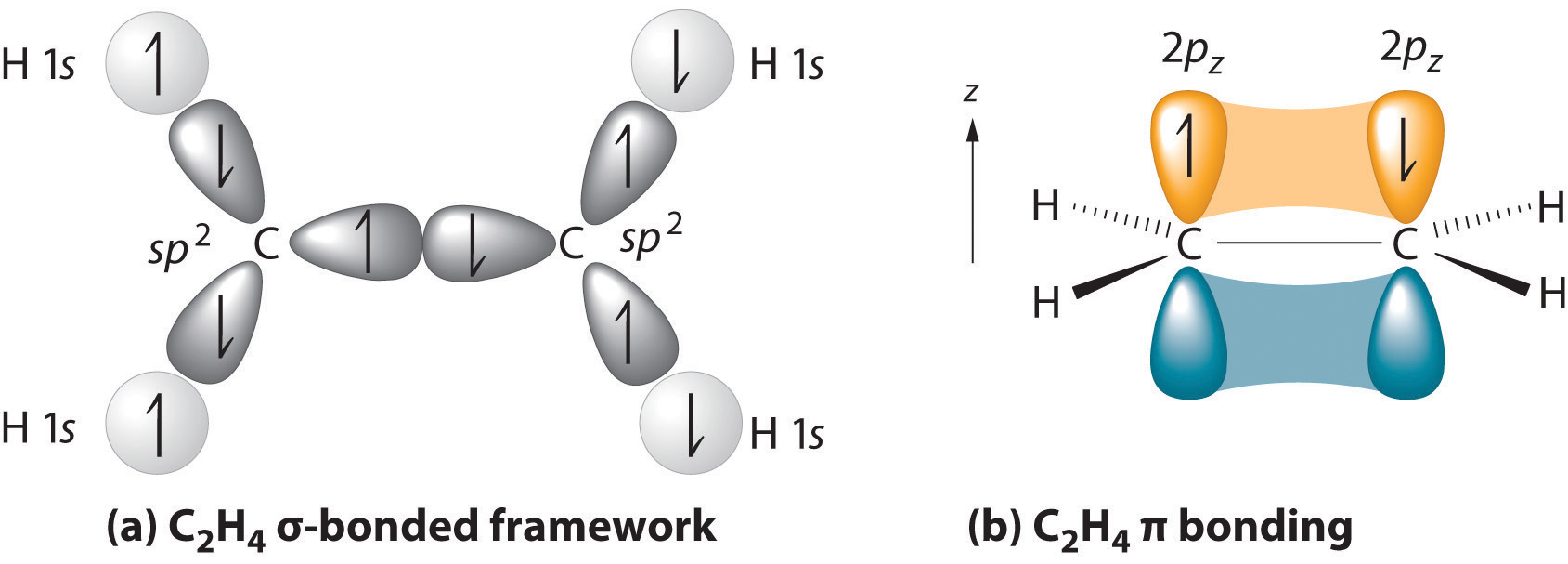
La struttura genitore è la catena più lunga contenente entrambi gli atomi di carbonio del doppio legame., I due atomi di carbonio del doppio legame e quattro atomi collegati ad esse giacciono in un piano, con angolo di legame di circa 120° Un doppio legame si compone di un legame sigma formata dalla sovrapposizione di sp2 orbitali ibridi e uno pi bond formata dalla sovrapposizione di parallelo 2 orbitali p
La formula molecolare di un idrocarburo fornisce informazioni sui possibili tipi strutturali che può rappresentare. Ad esempio, si consideri composti aventi la formula C5H8., La formula del pentano alcano a cinque atomi di carbonio è C5H12, quindi la differenza nel contenuto di idrogeno è 4. Questa differenza suggerisce tali composti possono avere un legame triplo, due doppi legami, un anello più un doppio legame, o due anelli. Alcuni esempi sono mostrati qui, e ce ne sono almeno altri quattordici!