Finora, abbiamo esaminato i modi in cui coppie di orbitali atomici potrebbero combinarsi per formare orbitali molecolari to per formare legami. Proprio come pensiamo che ci sia una progressione degli orbitali atomici dall’energia più bassa alla più alta (1s, 2s, 2p, 3s…), possiamo organizzare questi orbitali molecolari per ordine della loro energia.
In larga misura, si può considerare che l’ordine degli orbitali molecolari in energia segue l’ordine degli orbitali atomici da cui sono costruiti., Ci sono alcune partenze da quella regola, a volte, ma questo è il punto di partenza più semplice. Quindi, in una molecola, gli orbitali molecolari a più bassa energia sarebbero quelli formati dagli orbitali atomici a più bassa energia, gli orbitali 1s.
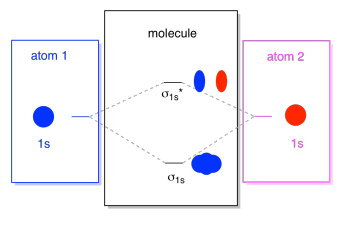
Quello che vediamo qui è un diagramma di interazione orbitale molecolare. Il centro del diagramma è solo il diagramma di energia orbitale molecolare. È analogo al diagramma di energia orbitale atomica (che va 1s, 2s, 2p, 3s…). L’ordine di energia finora è σ1s, σ1s*., I lati del diagramma si riferiscono solo al punto da cui provengono quegli orbitali molecolari, con linee tratteggiate che ti guidano da un luogo all’altro. Complessivamente, l’immagine dice che l’orbitale 1s su un atomo e l’orbitale 1s sull’altro atomo possono combinarsi in due modi diversi, producendo l’energia inferiore, legando σ1s e l’energia superiore, antibonding σ1s*.
Nota che non abbiamo ancora aggiunto elettroni a quel diagramma di energia orbitale molecolare, ma quando lo faremo, li riempiremo dal basso verso l’alto, proprio come faremmo con un diagramma di energia orbitale atomica.,
Il prossimo insieme più basso di orbitali atomici è il livello 2s. Questi orbitali sferici si combinerebbero molto come orbitali 1s, e otterremmo un diagramma simile, solo a un livello di energia leggermente più alto.
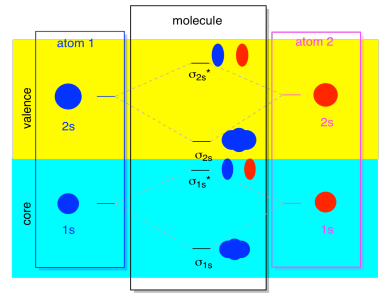
La maggior parte delle volte, non vedremo sia i σ1 che i σ2 visualizzati nel diagramma. Questo perché se ci sono elettroni 2s, allora quegli elettroni 1s sono davvero elettroni di base, non valenza. Sono sepolti un po ‘ più in profondità nell’atomo e non svolgono un ruolo molto importante nel legame., Ignorare gli elettroni del nucleo è abbastanza comune; se ricordi, nelle configurazioni di elettroni atomici potremmo scrivere 2s22p4 invece di 1s22s22p4 per l’ossigeno; stavamo ignorando il nucleo. Quando abbiamo disegnato le strutture di Lewis, abbiamo dato all’ossigeno sei elettroni, anziché otto; stavamo ignorando il nucleo.
Nel contesto di MO, supponiamo di avere elettroni 2s. Ciò deve significare che ogni atomo ha due elettroni 1s propri, per un totale di quattro. Quando questi quattro elettroni sono riempiti nel diagramma MO dal basso verso l’alto, occuperanno sia il legame σ1s che l’antibonding σ1s*., L’effetto di entrambe queste combinazioni di essere occupato è quello di annullare il legame; quelle due coppie di elettroni rimangono non-legame. Quindi possiamo ignorarli e non ci manca davvero nulla.
Gli orbitali 2s non sono gli unici nella seconda shell. Ci sono anche orbitali 2p. Ricorda, ci sono un paio di modi molto diversi in cui gli orbitali p possono combinarsi tra loro, a seconda dell’asse in cui si trovano. Se non giacciono paralleli tra loro-cioè, se sono perpendicolari tra loro, come un px e un py-allora non possono interagire tra loro., Il pz su un atomo potrebbe interagire con il pz sull’altro atomo, tuttavia, perché sono paralleli tra loro.
Di solito, definiamo l’asse z come situato lungo la linea tra i due atomi che stiamo guardando. Due orbitali pz giacciono lungo quell’asse, ciascuno con un lobo che si estende nello spazio tra gli atomi, e ciascuno con un altro lobo che si estende via, nell’altra direzione
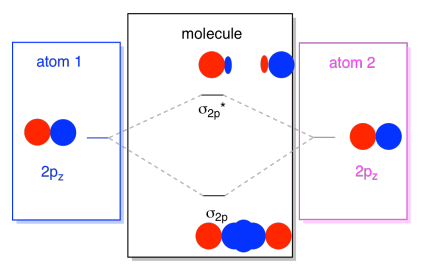
Le combinazioni risultanti sono chiamate σ perché giacciono lungo l’asse tra gli atomi (questo è esattamente ciò che σ significa, in termini di legame)., Esiste una combinazione σ, se i lobi sovrapposti sono in fase l’uno con l’altro, e σ* combinazione, se quei lobi sono fuori fase l’uno con l’altro. Poiché questi nuovi orbitali derivano dagli orbitali atomici 2p, li chiamiamo σ2p e σ2p*.
Ci sono anche quegli orbitali p che non giacciono lungo l’asse del legame, o l’asse tra i due atomi. Gli orbitali px sono perpendicolari agli orbitali pz che abbiamo appena visto, e quindi perpendicolari all’asse tra i legami. Tuttavia, sono ancora paralleli tra loro e possono ancora formare combinazioni., Questi due orbitali formerebbero una combinazione in fase e una combinazione fuori fase.
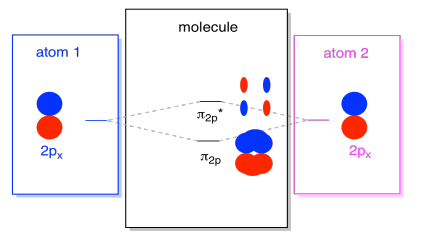
Si noti che la separazione energetica tra queste due combinazioni è un po ‘ più piccola del divario tra i livelli σ2p e σ2p*. La differenza è legata al grado di sovrapposizione tra gli orbitali atomici. Gli orbitali sull’asse proiettano fortemente nello stesso spazio; si sovrappongono molto e interagiscono fortemente. Gli orbitali fuori asse si sfiorano l’uno contro l’altro, interagendo meno fortemente e causando cambiamenti energetici più piccoli., Il divario tra l’orbitale n2p e l’orbitale n2p* è quindi molto più piccolo di quello tra gli orbitali σ2p e σ2p*.
Ci sono in realtà due di quegli orbitali p fuori asse. Oltre al set px, avremmo un set py. Se il set px è nel piano dello schermo, il set py ha un orbitale che sporge davanti e uno nascosto dietro. Tuttavia, le combinazioni tra i due orbitali py sono esattamente le stesse di quelle che abbiamo visto tra i due orbitali px. Sono appena ruotati in un piano perpendicolare rispetto alle combinazioni px.,
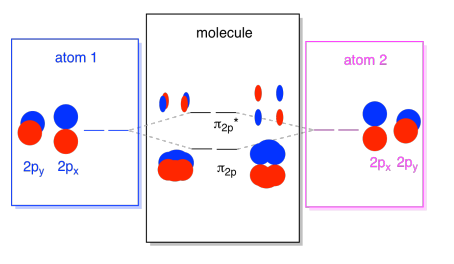
Possiamo mettere insieme tutti quegli orbitali basati su 2p in un diagramma. Sta iniziando a diventare un po ‘ più affollato, ma questo diagramma è solo una combinazione dei pezzi che abbiamo già visto. Nota che gli orbitali atomici px, py e pz iniziano tutti con la stessa energia (li abbiamo impilati qui in modo che tu possa ancora vedere la correlazione tra gli orbitali atomici e molecolari). Ciò significa che gli orbitali n2p & n2p* saranno “annidati” tra gli orbitali σ2p & σ2p*.,
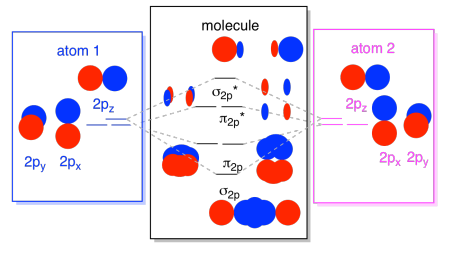
Infine, tenendo presente che gli orbitali 2p sono più alti di energia rispetto agli orbitali 2s, possiamo combinare quelle immagini in un unico diagramma. Ancora una volta, abbiamo visto questi singoli pezzi prima; li stiamo solo assemblando ora.
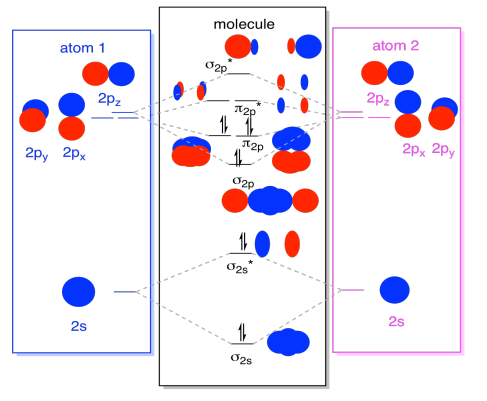
Mentre ci siamo, possiamo aggiungere gli elettroni. Come? È solo il numero totale di elettroni di valenza. Per un esempio, abbiamo usato N2., Ogni azoto ha cinque elettroni di valenza, per un totale di dieci, quindi abbiamo appena riempito dieci elettroni, iniziando dalla parte inferiore del diagramma del livello di energia orbitale molecolare. Se questa fosse un’altra molecola, come F2 o O2, costruiremmo il diagramma generale in modo simile, ma useremmo solo un numero diverso di elettroni.
L’immagine orbitale che abbiamo descritto sopra è in realtà solo una potenziale immagine della struttura elettronica del dinitrogeno (e di qualsiasi altro gruppo principale o blocco p biatomico)., Non avremo un’immagine reale della struttura del dinitrogeno finché non popoleremo questi livelli potenziali con elettroni.
- Solo i livelli di energia con gli elettroni hanno un effetto sull’energia (e sul comportamento) della molecola.
In altre parole, l’energia degli elettroni determina il comportamento della molecola. Gli altri livelli di energia sono solo possibilità che rimangono insoddisfatte.
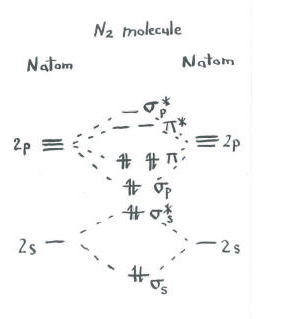
Pensa all’immagine di dinitrogen.
- Ogni azoto ha cinque elettroni di valenza.
- Ci sono un totale di dieci elettroni.,
- Due vanno ciascuno nei livelli s s bonding e s s * antibonding. Ricorda, li abbiamo tenuti separati dal set p come semplificazione.
- Due vanno ciascuno nel legame s p e ciascuno dei livelli di legame P.
Gli orbitali rimanenti (s p* antibonding e ciascuno dei livelli p * antibonding) non sono occupati. Questi sono livelli immaginari che non svolgono un ruolo nel determinare l’energia del dinitrogeno. In un calcolo orbitale molecolare reale, gli elettroni in questi livelli contribuirebbero all’energia complessiva della molecola.,
Otteniamo ulteriori informazioni da questa immagine. Ad esempio, possiamo vedere l’ordine di legame in dinitrogen.
- L’ordine di legame è solo il numero di legami tra una coppia di atomi.
- L’ordine del legame è uno dei diversi fattori che influenzano la forza del legame covalente.
- Più alto è l’ordine del legame, più elettroni sono condivisi tra gli atomi e più forte è il legame.
In dinitrogen, i livelli di legame s s s* antibonding si annullano a vicenda. Una coppia ha un’energia inferiore a quella dell’atomo, ma l’altra è più alta., Non c’è un calo netto di energia. Questi elettroni non contribuiscono a un legame azoto-azoto. Queste sono coppie di elettroni non leganti.
I sei elettroni nel legame s p e nei livelli di legame p, tuttavia, rappresentano una diminuzione di energia dai livelli di energia negli atomi di azoto libero. Queste tre coppie di elettroni a bassa energia indicano tre legami tra gli atomi di azoto.
Ricordate, abbiamo fatto alcune scorciatoie in questa immagine, e un vero e proprio calcolo orbitale molecolare potrebbe dare risultati leggermente diversi., Tuttavia, rivelerebbe ancora un ordine di legame di tre e due coppie di elettroni non leganti.
Inoltre, a volte le immagini orbitali molecolari sono mostrate in modi diversi. Un diagramma di interazione orbitale molecolare mostra come gli orbitali atomici o molecolari si combinano insieme per creare nuovi orbitali. A volte, potremmo essere interessati solo ai livelli di energia orbitale molecolare stessi, e non da dove provengono. Un diagramma del livello di energia orbitale molecolare mostra solo i livelli di energia nella molecola., Spesso, ma non sempre, i diagrammi del livello di energia sono mostrati senza alcuna immagine degli orbitali, al fine di focalizzare l’attenzione sui livelli di energia, che in modo fondamentale sono la parte più importante dell’immagine. Inoltre, poiché solo i livelli di energia occupati contribuiscono effettivamente all’energia della molecola, a volte gli orbitali non occupati di energia superiore vengono lasciati fuori dal quadro.

Molto spesso i risultati dei calcoli degli orbitali molecolari rafforzano ciò che prevederemmo dalle strutture di Lewis., Se disegnate una struttura di Lewis di dinitrogen, prevederete anche un triplo legame azoto-azoto. Il vantaggio principale della teoria degli orbitali molecolari è che consente la previsione quantitativa dell’energia quando facciamo un calcolo reale su un computer. Inoltre, è importante rendersi conto che non esiste una vera ragione per la regola dell’ottetto a meno che non consideriamo la meccanica quantistica. Le strutture di Lewis sono fondate su un’osservazione empirica che gli elettroni formano coppie e ottetti, senza tentare di spiegare perché., La teoria degli orbitali molecolari prende alcune relazioni fondamentali dalla fisica e le applica a molecole molto complicate con un ottimo successo. Solo conoscendo il numero di elettroni nella molecola e conoscendo approssimativamente dove si trovano i nuclei nella struttura, i calcoli orbitali molecolari forniscono informazioni molto utili sull’energia. Inoltre, nei casi più complicati di N2, questi calcoli possono anche correggere la nostra prima ipotesi sulla geometria molecolare e dove si trovano i legami.,
Esercizio \(\PageIndex{2}\)
Un diagramma orbitale molecolare per una molecola biatomica (due atomi) varia nel numero di elettroni. Come si popolano gli elettroni?
Risposta • * Contare gli elettroni di valenza sulla molecola. Questo è il numero di elettroni di valenza su ogni atomo, regolato per qualsiasi carica sulla molecola. (ad esempio C22-ha 10 elettroni di valenza: 4 da ogni carbonio-questo è 8-e altri due per la carica 2).
• Riempire gli elettroni negli orbitali di energia più bassa prima.
• Coppia elettroni dopo tutti gli orbitali allo stesso livello di energia hanno un elettrone.,
Esercizio \(\PageIndex{3}\)
Costruisci un diagramma orbitale molecolare qualitativo per il cloro, Cl2. Confronta l’ordine del legame con quello visto nella struttura di Lewis (ricorda che un elettrone in un orbitale antibonding annulla la stabilizzazione dovuta al legame di un elettrone in un orbitale di legame).
Risposta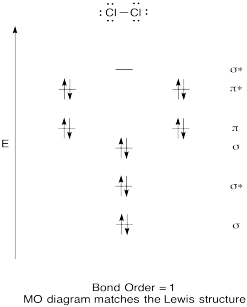
Esercizio \(\PageIndex{4}\)
- Costruisci un diagramma orbitale molecolare qualitativo per ossigeno, O2.
- Confronta l’ordine del legame con quello visto nella struttura di Lewis.,
- In quale altro modo questa immagine MO di ossigeno si confronta con la struttura di Lewis? Cosa ti dicono le due strutture sull’accoppiamento degli elettroni?
- I composti che hanno tutti i loro elettroni accoppiati sono indicati come diamagnetici. Quelli con elettroni spaiati sono indicati come paramagnetici. I materiali paramagnetici sono attratti da un campo magnetico, ma le cose diamagnetiche non lo sono. Come ti aspetteresti che l’ossigeno molecolare si comporti?,
Risposta
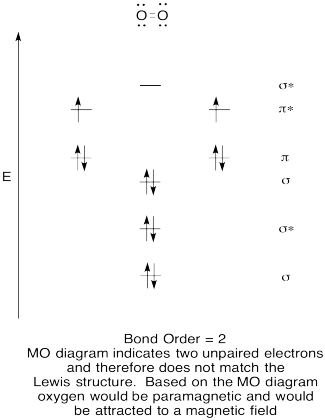
Esercizio di \(\PageIndex{5}\)
- Costruire un qualitativi orbitale molecolare-schema di perossido di anione, O22-.
- Confronta l’ordine del legame con quello visto nella struttura di Lewis.
- In quale altro modo questa immagine MO di ossigeno si confronta con la struttura di Lewis? Cosa ti dicono le due strutture sull’accoppiamento degli elettroni?,
- Sulla base di immagini orbitali molecolari, quanto facilmente pensi che il diossigeno possa essere ridotto a perossido (attraverso l’aggiunta di due elettroni)?
Risposta
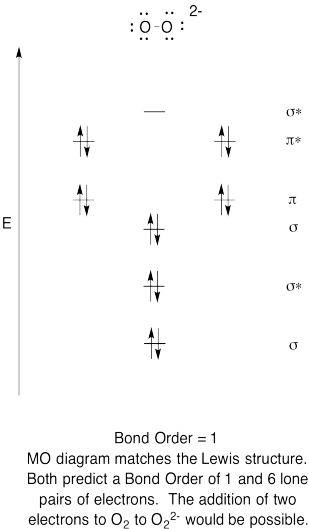
Esercizio \(\PageIndex{6}\)
Costruisci un diagramma orbitale molecolare qualitativo per diboron, B2. Pensi che i legami boro-boro potrebbero formarsi facilmente, sulla base di questa immagine?,
Risposta
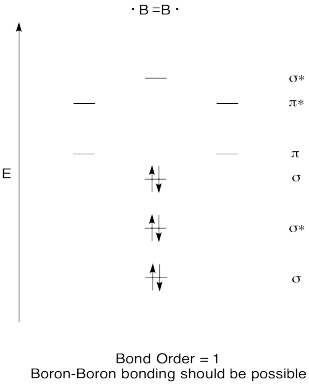
Esercizio di \(\PageIndex{7}\)
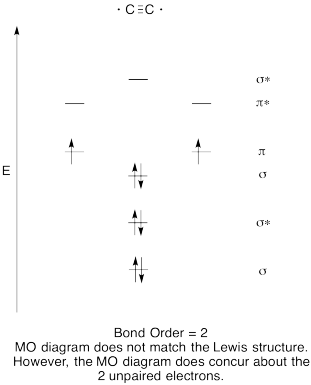
- Costruire un qualitativi orbitale molecolare diagramma per dicarbon, C2.
- Confronta l’ordine del legame con quello visto nella struttura di Lewis.
- In quale altro modo questa immagine MO di ossigeno si confronta con la struttura di Lewis? Cosa ti dicono le due strutture sull’accoppiamento degli elettroni?,
Risposta
Esercizio di \(\PageIndex{8}\)
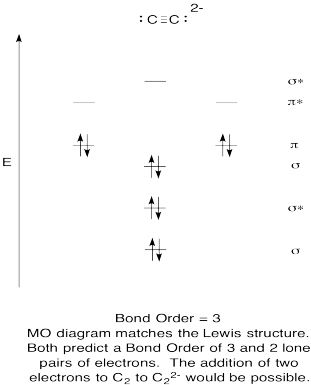
- Costruire un qualitativi orbitale molecolare diagramma per acetylide anione, C22-.
- Confronta l’ordine del legame con quello visto nella struttura di Lewis.
- In quale altro modo questa immagine MO di ossigeno si confronta con la struttura di Lewis? Cosa ti dicono le due strutture sull’accoppiamento degli elettroni?,
- Sulla base di immagini orbitali molecolari, quanto facilmente pensi che dicarbon potrebbe essere ridotto ad acetilide (attraverso l’aggiunta di due elettroni)?
Risposta
Esercizio \(\PageIndex{9}\)
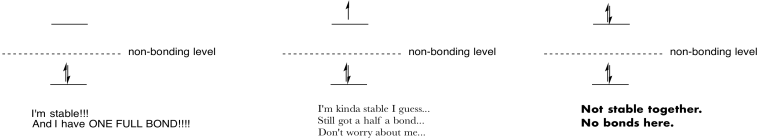
Crea disegni e note per riassumere l’effetto di popolamento degli orbitali antibonding.
Risposta
Attribuzione
Chris P Schaller, Ph. D.,, (Collegio di San Benedetto / Università di San Giovanni)