Richard Baxter és Jim Britton
hogyan korrodálódik az acél a vízben?
a katódos védelem megértéséhez először meg kell értenie a korrózió okát. A korrózió bekövetkezéséhez három dolognak kell lennie:
1. Két különböző fém
2. Elektrolit (víz bármilyen só vagy sók feloldva)
3., A két eltérő fém közötti fém (vezető) út lehet teljesen különböző ötvözetek – például acél és alumínium -, de nagyobb valószínűséggel lehetnek mikroszkopikus vagy makroszkopikus metallurgiai különbségek egyetlen darab acél felületén. Ebben az esetben a szabadon korrodáló acélt vesszük figyelembe, amely nem egységes.
Ha a fenti feltételek fennállnak, a következő reakció az aktívabb helyeken történik: (két vasion plusz négy szabad elektron).,
2Fe => 2Fe++ + 4e-
A szabad elektronok utazás a fém utat, hogy a kevésbé aktív területek, ahol a következő reakció játszódik: (oxigén gáz alakul át oxigén ion – kombinálásával a négy szabad elektronok – amely egyesíti a vizet, hogy a forma hidroxil ionok).
O2 + 4e- + 2H20 => 4 OH-
Recombinations ezek az ionok az aktív felület előállítására a következő reakció, amely a hozamok a vas-korrózió termék, vas-hidroxid: (vas ötvözi az oxigén, a víz formájában vas-hidroxid).,
2Fe + O2 + 2H2O = > 2FE (OH)2
ezt a reakciót gyakrabban úgy írják le, mint ” az anódból (aktívabb helyről) a katódra (kevésbé aktív helyre) áramló víz.’
hogyan állítja le a katódos védelem a korróziót?
Katód-védelem megakadályozza a korróziót átalakításával a anodic (aktív) oldalak a fém felület katód (passzív) oldalak által szállított elektromos áram (vagy szabad elektronok) egy másik forrás.
általában ez galvanikus anódok formájában történik, amelyek aktívabbak, mint az acél., Ezt a gyakorlatot áldozati rendszernek is nevezik, mivel a galvanikus anódok feláldozzák magukat, hogy megvédjék a szerkezeti acélt vagy a csővezetéket a korróziótól.
alumínium anódok esetén az alumínium felületén a reakció: (négy alumínium Ion plusz tizenkét szabad elektron)
4AL = > 4AL+++ + 12 e –
és az acél felületén: (oxigéngáz oxigénionokká alakul át, amelyek vízzel hidroxilionokat képeznek).,
3O2 + 12E – + 6H20 = > 12oh-
mindaddig, amíg az áram (szabad elektronok) gyorsabban érkezik a katódra (acél), mint az oxigén érkezik, nem következik be korrózió.,
Alapvető szempont a tervezés során áldozati anód rendszerek
Az elektromos áram egy anód bevezetések által ellenőrzött, Ohm törvénye, ami van:
I=E/R
I= Áram áramlását amper
E= Különbség a potenciális között, az anód pedig katód v
R= Teljes áramkör ellenállás ohm
Kezdetben jelenlegi magas lesz, mert a különbség a potenciális között, az anód pedig katód magas, de mivel a potenciális különbség csökken, mivel a hatás a jelenlegi flow-ra a katód, a jelenlegi fokozatosan csökken miatt polarizáció a katód., Az áramkör ellenállása magában foglalja mind a víz útját, mind a fém utat, amely magában foglalja az áramkör bármely kábelét. A domináns érték itt az anód ellenállása a tengervíznek.
a legtöbb alkalmazás esetében a fém ellenállása olyan kicsi a vízállósághoz képest, hogy figyelmen kívül hagyható (bár ez nem igaz a szánokra vagy a mindkét végtől védett hosszú csővezetékekre). Általában a hosszú, vékony anódok alacsonyabb ellenállással rendelkeznek, mint a rövid, zsíros anódok. Több áramot bocsátanak ki, de nem tartanak olyan sokáig.,
Ezért a katód-védelem tervező kell mérete a anódok hogy a megfelelő forma, felület kiegyenlítésére elég aktuális, hogy megvédje a szerkezet pedig elég súlyt, hogy elmúlt a kívánt élettartam, ha kisütés ez a mostani.
általános hüvelykujjszabályként:
az anód hossza határozza meg, hogy az anód mennyi áramot képes előállítani, következésképpen hány négyzetlábnyi acél védhető. A keresztmetszet (súly) meghatározza, hogy az anód mennyi ideig képes fenntartani ezt a védelmi szintet.,
impacted-current katódos védelmi rendszerek (ICCP anódrendszerek)
mivel a nagy áramok részt számos tengervíz rendszerek, nem ritka, hogy a lenyűgözött-jelenlegi rendszerek használata anódok olyan típusú (ICCP anódok), amelyek nem könnyen oldható fémionok. Ez alternatív reakciót okoz: az oldott kloridionok oxidációját.
2CL- = > Cl2 + 2E-
a tápellátást egy külső egyenáramú tápegység biztosítja.,

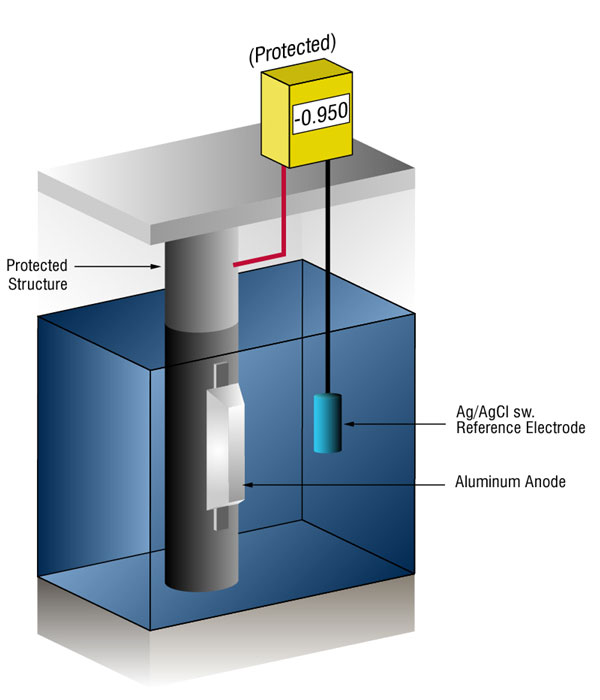
honnan tudjuk, hogy van-e elegendő katódos védelem?
ellenőrizhetjük, hogy van-e elegendő áram az acél potenciáljának mérésével egy szabványos referenciaelektróddal, általában ezüst/kloriddal (Ag/AgCl sw.), de néha cink (sw.).
Az áram bármely fémre történő áramlása negatív irányba változtatja normál potenciálját. A történelem azt mutatja, hogy ha az acél elegendő áramot kap ahhoz, hogy a potenciált (-) 0.800 V vs., silver / silver chloride (Ag / AgCl), the corrosion is essentially stopped.
 |
 |