a kinetika vizsgálata lehetővé teszi a tudósok számára, hogy meghatározzák a körülmények változása és egy adott kémiai reakció sebessége közötti összefüggést. Az egyik legfontosabb tényező, amely befolyásolja a reakció sebességét, az adott reakcióban részt vevő vegyi anyagok reaktivitása; továbbá számos változó is befolyásolhatja a reakció sebességét (koncentráció, hőmérséklet, katalizátor stb.).).
az egyik ilyen változó ütközésnek minősül.,
minden kémiai reakcióhoz ütközésre van szükség a reaktáns részecskék (atomok és/vagy molekulák) között. Másrészt nem minden ütközés elősegíti a reakciót. Ehelyett, ha az ütköző részecskék nem rendelkeznek elegendő kinetikus energiával vagy megfelelő orientációval az űrben, a reakció nem következik be.
de mit jelent az “elegendő energia” vagy a “megfelelő orientáció”? Ahhoz, hogy jobban megértsük a korábban említett fogalmakat, a cikk néhány általános fogalommeghatározást tartalmaz, amelyeket megfelelő példák és mintaproblémák kísérnek.,
fő célunk az aktiválási energia fogalmának meghatározása, valamint annak magyarázata, hogy egyes ütközések miért nem eredményeznek reakciót.
ennek megfelelően ez a cikk elsősorban a reaktív ütközés fogalmára összpontosít. Ezzel együtt röviden áttekintünk néhány olyan forgatókönyvet, amelyek nem aktív ütközéseket tartalmaznak. Mivel az ütközések két fő jellemzővel, az energiával és a térbeli tájékozódással kapcsolatosak, ezeket a kifejezéseket is megvitatjuk.,
Ütközéselmélet
amint azt már említettük, két vagy több molekula közötti ütközésnek kell bekövetkeznie ahhoz, hogy kémiai reakció történjen. De az ütközés nem elegendő ahhoz, hogy a reagensek termékekké alakuljanak. A molekuláknak elegendő energiával kell rendelkezniük, és ütközniük kell a helyes térbeli orientációval.
mint már tudjuk, vannak különböző típusú reakciók, beleértve a szintézist, bomlás, elmozdulás, égés., Figyelembe véve azt a tényt, hogy ütközési elmélet középpontjában a reakciók érintő ütközések között két faj, nem kell aggódnod bomlási reakciók, mivel ilyen esetekben egyetlen vegyület szétesett, pedig nincs szükség, hogy fontolja meg, ütközések, vagy tájékozódás a részecskék a tér.
két fajt érintő reakciók esetén a molekulák közötti ütközések elengedhetetlenek a reakció folytatásához; de csak a megfelelő kinetikus energiával és releváns térbeli orientációval rendelkező molekulák ütközése okozhat reakciót., Így energiára van szükség a kötések megtöréséhez a reagáló molekulákon belül, míg a molekulák térbeli orientációja fontos szerepet játszik a megfelelő atomok egymáshoz való sorba állításában, hogy a törött kötéseket megfelelő módon megreformálják.
ha mindkét kritérium teljesül, az ütközést sikeres, hatékony vagy reaktív ütközésnek kell tekinteni.
figyelembe véve a fent említett két tényező (energia és orientáció) fontosságát, folytatnunk kell a fogalmak és fogalmak további magyarázatát az ütközéselmélet alapelveinek jobb megértése érdekében.,
aktiválási energia
amint azt korábban már említettük, a részecskéknek elegendő energiával kell ütközniük ahhoz, hogy a reakció bekövetkezzen. Ez a reakció folytatásához szükséges minimális energia az aktiválási energia.,
Mint ön is tudja, kétféle reakciót vonatkozó energia kiadás vagy a felszívódás, amely a következő:
- Endoterm reakció – energia elnyelődik a reakciót (általában a formák hő)
- Exoterm reakció – energia szabadul fel egy reakció (általában a formák hő)
első pillantásra, úgy tűnhet, hogy mivel energia szabadul fel egy exoterm reakció, nem szabad semmiféle kell bemenet egy kis energiát a reakció fordul elő. Éppen ellenkezőleg, mind az endoterm, mind az exoterm kémiai reakciók energiát igényelnek az induláshoz.,
úgy tűnik, egy kicsit furcsa, jobb? Miért van szükség egy reakcióra az energia bevitelére, ha az energia következésképpen felszabadul?
tekintsük a következő példákat a mindennapi életünkben előforduló exoterm reakciókra.

példa #1 – gyertya égetése
a gyertya égése hőt bocsát ki; ezért a folyamat során fellépő reakció exotermikus. Nyilvánvaló, hogy a gyertyát gyufával vagy öngyújtóval kell meggyújtania., Ez azt jelenti, hogy bizonyos energiát kell bevinnie ahhoz, hogy a gyertya kigyulladjon. Ezután a reakciónak elegendő energiája van a következő lépésekhez, a gyertya pedig továbbra is energiát éget.
azonban egy gyertya önmagában soha nem fog lángolni, igaz?
példa # 2-gyufa megvilágítása

a tipikus gyufafej különböző oxidálószerekkel kevert kénből áll. A gyufaszál meggyújtásához dörzsölje a gyufafejet a gyufásdoboz speciális oldalára., E folyamat során reakció lép fel, és energiát bocsát ki fény és hő formájában. Így a reakciót exotermnek tekintik. Bár még mindig meg kell adnia egy kis energiát a gyufaszálhoz az égéshez. Ezt az energiát az “aktiválási energia” kifejezés határozza meg.”Az előző példához hasonlóan, mindaddig, amíg elegendő energiát biztosít a gyufaszál világításához, továbbra is önmagában éget, és hőt bocsát ki.
aktiválási energiagráf a kémiai reakció során bekövetkező energiaváltozásokat ábrázolja.,
az aktiválási energiagráf ábrázolásához elengedhetetlen két változó megfontolása:
- a különböző molekulák közötti ütközések száma
- az ütköző molekulák kinetikus energiája
az első változó meglehetősen könnyű megérteni, mivel közvetlen jelentése van – meghatározza a két faj részecskéi közötti ütközések számát másodpercenként.
a második változó az ütköző molekulák kinetikus energiája, amely a molekulák mozgásának energiájaként definiálható.
- endoterm reakció-az energia felszívódik., A reagensek energiája alacsonyabb, mint a termékek energiája.
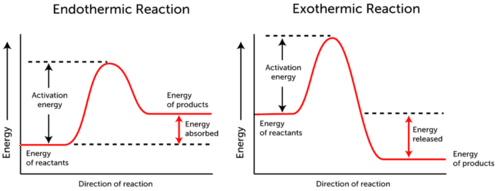
- exotermikus Reakcióenergia szabadul fel. A reagensek energiája több, mint a termékek energiája.
amint az a fenti két grafikonon látható, az aktiválási energia mind az endoterm, mind az exoterm reakciók esetében azonos.,
mivel az endoterm reakció nem képes annyi energiát előállítani, amennyit a reakció bekövetkezéséhez el kell fogyasztania, az energia felszívódik; ezért a termékek energiája magasabb, mint a reaktánsok energiája.
éppen ellenkezőleg, az exoterm reakciók több energiát termelnek, mint amennyit aktiválási energiaként használnak. Ennek eredményeként az energia felszabadul, a termékek pedig alacsonyabb energiával rendelkeznek, mint a reagensek.,
következtetésként megállapítható, hogy még akkor is, ha a reaktáns molekulák gyorsan ütköznek egymással, elengedhetetlen, hogy a molekulák elegendő energiával rendelkezzenek a reakció kialakulásához.
térbeli orientáció
az ütközéselmélet szerint nem minden ütközés sikeres, még akkor is, ha a reaktáns molekulák elegendő aktiválási energiával rendelkeznek. A molekuláknak a megfelelő módon is ütközniük kell.
tehát a reaktív ütközéseket befolyásoló második szempont térbeli orientációnak tekinthető (a molekulák térbeli orientációja).,
mit jelent a molekulák” megfelelő ” orientációja a reakcióban?
amikor két molekula ütközik, mindkét molekulát úgy kell elhelyezni, hogy könnyen reagálhassanak. A koncepció teljes megértéséhez fontos kiemelni a reakció mechanizmusát.
vegyük példának a propilén (vagy propén) és a hidrogén-bromid közötti reakciót:

mint látható, a reakció a fentiekből következik 2 lépésben.,
1. Lépés: a kettős kötés megtört
2. Lépés: a bróm csatolt
ez A reakció, a molekuláris irányok a HBr, valamint C3H6 fontos szerepet játszanak, mivel az egyik volt elhelyezkedő, más módon, nem lett volna lehetséges a H atom megközelíteni a propilén molekula.
Ez minden reakcióra igaz. Minden molekulának megfelelő orientációval kell rendelkeznie az űrben a reakció végrehajtásához. A helyes tájékozódás biztosítja, hogy a molekulák úgy legyenek elhelyezve, hogy viszonylag könnyen ütközhessenek és reagálhassanak.,
megállapíthatjuk, hogy a reaktáns molekulák kedvező orientációja ugyanolyan lényeges, mint a megfelelő aktiválási energia.
összefoglaló
a cikkben meghatározott kifejezéseket és fogalmakat az alábbi táblázat foglalja össze:
| Ütközéselmélet | elmagyarázza, hogy a részecskék kölcsönhatásba kell lépnie vagy egymással, hogy reakciót okozzon., Szerint az Ütközési Elmélet, két feltételnek kell teljesülnie ahhoz, hogy egy kémiai reakció zajlik: a Molekulák kell ütköznek elegendő aktiválási energia, hogy szünet, majd újra formában meglévő kötvények; Molekulák kell ütköznek kedvező térbeli tájékozódás. | |
| sikeres ütközés (más néven hatékony vagy reaktív ütközés) | megfelelő aktiválási energiával rendelkező molekulák ütközése és megfelelő térbeli orientáció, amely kémiai reakciót eredményez., | |
| aktiválási energia | a reakció bekövetkezéséhez szükséges minimális energia. Az energia bevitelére endoterm, valamint exoterm reakciók esetén van szükség. | |
| endoterm reakció | energia (hő) felszívódik; a reaktánsok energiája alacsonyabb, mint a termékek energiája; nem képes annyi energiát előállítani, amennyit a reakció során fogyaszt., | |
| Exoterm reakció | energia (hő) szabadul fel; a reaktánsok energiája magasabb, mint a termékek energiája; több energiát képes előállítani, mint amennyit a reakció során fogyaszt. | |
| molekuláris orientáció | a molekulák térbeli orientációja., |
Three different scenarios are represented in the picture attached below:
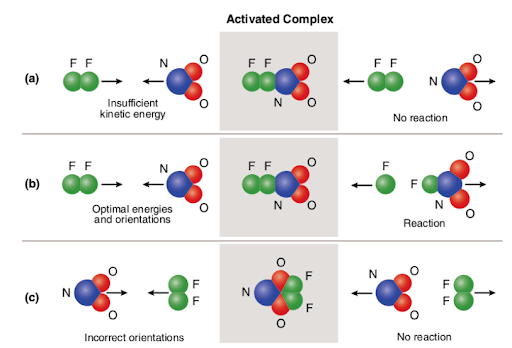
The picture summarizes the concept of collision theory utilizing two reactant molecules (fluorine (F2) and molecular nitrogen dioxide (NO2)) and three different cases to form nitrogen oxyfluoride.,
(a) esetén a reagens molekulák megfelelő térbeli orientációval rendelkeznek, de nem rendelkeznek elegendő aktiválási energiával; ezért a reakció nem fordul elő annak a ténynek köszönhetően, hogy nincs elég energia a kötések megszakításához. Tehát a két molekula közötti ütközés nem aktívnak tekinthető.
(b) esetén a reaktáns molekulák mind elegendő aktiválási energiával, mind megfelelő orientációval rendelkeznek az űrben. A molekulák optimális jellemzői miatt a reakció folytatódik, nitrogén-oxifluorid képződik., Tehát a két molekula közötti ütközés reaktív.
(c) esetén a reaktáns molekulák elegendő aktiválási energiával rendelkeznek, de nem helyezkednek el megfelelően az űrben; ezért a reakció nem történik meg, mivel a molekulák nem érhetik el egymást a kötések megszakításával. Tehát, hasonlóan az első esethez, a két molekula közötti ütközés nem aktívnak tekinthető.