10.2 Brønsted-Lowry meghatározása savak és bázisok
tanulási célok
- felismerni a vegyület, mint egy Brønsted-Lowry sav vagy egy Brønsted-Lowry bázis.
- illusztrálja a protonátadási folyamatot, amely meghatározza a Brønsted-Lowry sav-bázis reakciót.
Az ammónia (NH3) növeli a hidroxid ion koncentrációját vizes oldatban úgy, hogy vízzel reagál, ahelyett, hogy közvetlenül felszabadítaná a hidroxidionokat., Valójában egy sav és egy bázis Arrhenius definíciói a hidrogénionokra és a hidroxidionokra összpontosítanak. Vannak-e több alapvető meghatározások savak és bázisok?
1923-ban Johannes Brønsted dán tudós és Thomas Lowry angol tudós önállóan új meghatározásokat javasolt a savakra és bázisokra vonatkozóan. Ahelyett, hogy mind a hidrogén -, mind a hidroxidionokat figyelembe vennék, csak a hidrogénionra összpontosítottak. Egy Brønsted-Lowry acida vegyület, amely egy reakcióban hidrogénionot (H+) szolgáltat; egy proton donor. olyan vegyület, amely hidrogénionot szolgáltat egy reakcióban., Brønsted-Lowry alapegy vegyület, amely egy reakcióban hidrogénionot (H+) fogad el; egy proton akceptor. ezzel szemben egy olyan vegyület, amely hidrogénionot fogad el egy reakcióban. Így a Brønsted-Lowry meghatározások egy sav és egy bázis középpontjában a mozgását hidrogénionok egy reakció, ahelyett, hogy a termelés a hidrogénionok és hidroxid ionok vizes oldatban.
használjuk a vízben lévő ammónia reakcióját egy sav és egy bázis Brønsted-Lowry meghatározásának bemutatására., Ammónia, víz molekulák fehérjék, míg az ammónium-ion a-hidroxid-ion termékek:
NH3(aq) + H2O(ℓ) → NH4+(aq) + OH−(aq)
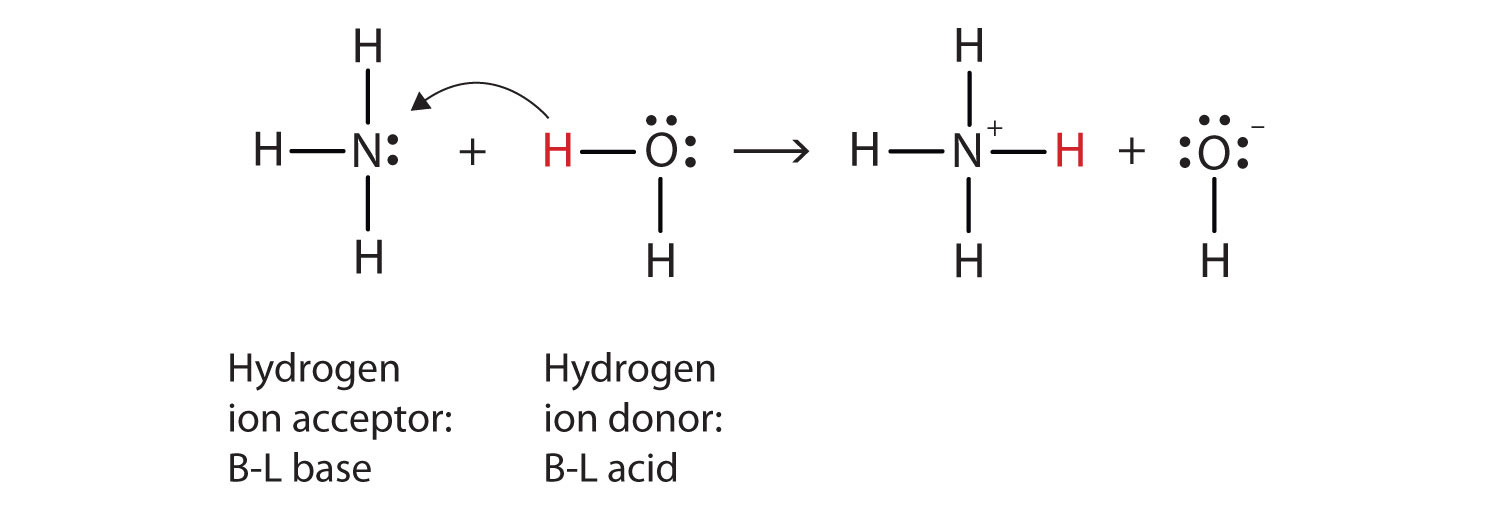
mivel a vízmolekula hidrogénionot ad az ammóniának, ez a Brønsted-Lowry sav, míg az ammónia molekula—amely elfogadja a hidrogénionot—a Brønsted-Lowry bázis., Így az ammónia mind az Arrhenius értelemben, mind a Brønsted-Lowry értelemben bázisként működik.
egy Arrhenius-sav, mint a sósav, még mindig sav a Brønsted-Lowry értelemben? Igen, de megköveteli tőlünk, hogy megértsük, mi történik valójában, amikor a HCl vízben oldódik. Emlékezzünk vissza, hogy a hidrogénatom egyetlen proton, amelyet egyetlen elektron vesz körül. A hidrogénion előállításához eltávolítjuk az elektronot, csupasz protont hagyva. Tényleg csupasz protonok lebegnek vizes oldatban? Nem, mi nem., Valójában az történik, hogy a H+ ion a H2O-hoz kötődik, hogy H3O+ – ot készítsen, amelyet hidrónium-ionnak neveznek. A legtöbb esetben a H+ és a H3O + ugyanazt a fajt képviseli, de a H3O+ helyett a H+ írás azt mutatja, hogy megértjük, hogy a megoldásban nincsenek csupasz protonok. Inkább ezek a protonok valójában oldószermolekulákhoz kapcsolódnak.
Megjegyzés:
A proton vizes oldatban körül több mint egy víz molekula, ami képletek, mint H5O2+ vagy H9O4+ ahelyett, H3O+. Egyszerűbb azonban a H3O+használata.,
ezt szem előtt tartva, hogyan határozzuk meg a HCl-t savként a Brønsted-Lowry értelemben? Fontolja meg, mi történik, ha a HCl feloldódik H2O-ban:
HCl + H2O(ℓ) → H3O+(aq) + Cl−(AQ)
ezt a folyamatot Lewis electron dot diagramok segítségével ábrázolhatjuk:
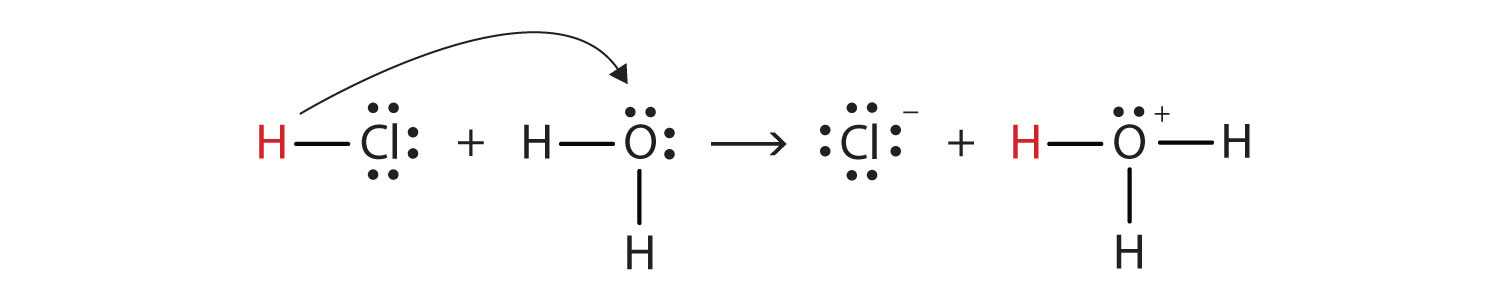
most látjuk, hogy a hidrogénion átkerül a HCl molekulából a H2O molekulába kloridionok és hidroniumionok előállítására. Hidrogénion donorként a HCl Brønsted-Lowry savként működik; hidrogénion-akceptorként a H2o egy Brønsted-Lowry bázis., Tehát a HCl nem csak Arrhenius értelemben, hanem Brønsted-Lowry értelemben is sav. Ezenkívül a Brønsted-Lowry definíciók szerint a H2o a vizes HCl képződésének alapja. Tehát egy sav és egy bázis Brønsted-Lowry definíciója a HCl vízben való feloldását egy sav és egy bázis közötti reakcióként osztályozza-bár az Arrhenius meghatározás ebben a körülmények között nem jelölte volna a H2O-t bázisnak.
Megjegyzés
minden Arrhenius sav és bázis Brønsted-Lowry savak és bázisok is. De nem minden Brønsted-Lowry savak és bázisok Arrhenius savak és bázisok.,
3.példa
az anilin (C6H5NH2) vízben enyhén oldódik. Van egy nitrogén atom, amely képes elfogadni a hidrogén-ion egy vízmolekula, mint a nitrogén atom ammónia nem. Írja le ennek a reakciónak a kémiai egyenletét, és azonosítsa a Brønsted-Lowry savat és bázist.
C6H5NH2 és H2o a reagensek. Amikor a c6h5nh2 Elfogad egy protont a H2O-ból, extra H-t és pozitív töltést kap, és OH− iont hagy maga után., A reakció a következő:
C6H5NH2(aq) + H2O(ℓ) → c6h5nh3+(aq) + OH−(AQ)
mivel a c6h5nh2 Elfogad egy protont, ez a Brønsted-Lowry bázis. A H2O molekula, mivel protont adományoz, a Brønsted-Lowry sav.
Készségfejlesztő gyakorlat
-
a koffein (C8H10N4O2) egy kávéban és teában található stimuláns. Vízben oldva képes elfogadni egy protont egy vízmolekulából. Írja le ennek a folyamatnak a kémiai egyenletét, és azonosítsa a Brønsted-Lowry savat és bázist.,
egy sav és egy bázis Brønsted-Lowry definíciója alkalmazható olyan kémiai reakciókra, amelyek a víztől eltérő oldószerekben fordulnak elő. A következő példa szemlélteti.
4. példa
a nátrium-amid (NaNH2) metanolban (CH3OH) oldódik, és nátriumionokká és amidionokká (NH2−) válik. Az amidionok metanollal reagálnak az ammónia és a metoxidion (CH3O−) előállítására. Írjon egy kiegyensúlyozott kémiai egyenletet ehhez a folyamathoz, és azonosítsa a Brønsted-Lowry savat és bázist.,
oldat
a reakció egyenlete NH2 és CH3OH között van, hogy NH3 és CH3O legyen− a következő:
NH2 – (solv) + CH3OH(ℓ) → NH3(solv) + CH3O−(solv)
a címke (solv) azt jelzi, hogy a faj valamilyen oldószerben oldódik, szemben az (aq) – val, amely vizes (H2O) oldatot határoz meg. Ebben a reakcióban azt látjuk, hogy az NH2− ion Elfogad egy protont egy CH3OH molekulából, hogy NH3 molekulát készítsen. Így, mint a proton akceptor, NH2 – a Brønsted-Lowry bázis. Mivel a proton donor, CH3OH a Brønsted-Lowry sav.,
Készségfejlesztő gyakorlat
-
piridinium-klorid (C5H5NHCl) etanolban (C2H5OH) oldódik, és piridiniumionokká (c5h5nh+) és kloridionokká válik. A piridinium-ion hidrogénionot képes átvinni egy oldószermolekulába. Írjon egy kiegyensúlyozott kémiai egyenletet ehhez a folyamathoz, és azonosítsa a Brønsted-Lowry savat és bázist.
az Ön egészségére: Brønsted-Lowry sav-bázis reakciók a gyógyszeriparban
a Brønsted-Lowry sav-bázis reakciók számos érdekes alkalmazása van a gyógyszeriparban., Például a gyógyszereknek gyakran vízoldhatónak kell lenniük a maximális hatékonyság érdekében. Sok komplex szerves vegyület azonban nem oldódik, vagy csak enyhén oldódik vízben. Szerencsére azok a gyógyszerek, amelyek proton-elfogadó nitrogénatomokat tartalmaznak (és sokan vannak), híg sósavval reagálhatók . A nitrogénatomok-amelyek Brønsted-Lowry bázisokként működnek-elfogadják a hidrogénionokat a savból, hogy ionokká váljanak, ami általában sokkal jobban oldódik vízben., A módosított gyógyszermolekulák ezután kloridsóként izolálhatók:
RN(sl aq) + H+(aq) → RNH+(aq) →Cl−(aq) rnhcl (s)
ahol az RN valamilyen nitrogént tartalmazó szerves vegyületet képvisel. A címke (sl aq) jelentése “enyhén vizes”, jelezve, hogy az RN vegyület csak enyhén oldódik. Az ilyen módon módosított gyógyszereket hidroklorid sóknak nevezik. Példák közé tartozik az erős fájdalomcsillapító kodein, amelyet általában kodein-hidrokloridként adnak be. A sósavtól eltérő savakat is használnak. A hidrobromsav például hidrobromid-sókat ad., A dextrometorfánt, amely számos köhögés elleni gyógyszer összetevője, dextrometorfán-hidrobromidként adják ki. A mellékelt ábra egy másik gyógyszert mutat, mint hidroklorid-sót.
a gyógyszer neve egyértelművé teszi, hogy hidrokloridsóként létezik.
© Thinkstock
koncepció felülvizsgálati gyakorlat
-
adja meg a Brønsted-Lowry sav és a Brønsted-Lowry bázis definícióit.,
válasz
-
a Brønsted-Lowry sav proton donor, míg a Brønsted-Lowry bázis proton akceptor.
Key Takeaways
- a Brønsted-Lowry sav proton donor, a Brønsted-Lowry bázis pedig proton akceptor.
- Brønsted-Lowry sav-bázis reakciók lényegében proton transzfer reakciók.
-
mindegyik reaktív, mint Brønsted-Lowry sav vagy Brønsted-Lowry bázis.,
HCl (aq) + NH3(AQ) → NH4 + (AQ) + Cl−(AQ)
-
mindegyik reaktív, mint Brønsted-Lowry sav vagy Brønsted-Lowry bázis.
H2O (ℓ) + N2H4 (AQ) → N2H5 + (aq) + OH−(AQ)
-
magyarázza el, hogy egy Brønsted-Lowry sav miért nevezhető proton donornak.
-
magyarázza el, miért nevezhetünk egy Brønsted-Lowry bázist proton akceptornak.
-
írja le az ammónia vízben való reakciójának kémiai egyenletét, és jelölje meg a Brønsted-Lowry savat és bázist.,
-
írja le a metilamin (CH3NH2) reakciójának kémiai egyenletét vízben, és jelölje meg a Brønsted-Lowry savat és bázist.
-
bizonyítsa, hogy a HNO3 vízben való feloldódása valójában egy Brønsted-Lowry sav-bázis reakció, kémiai egyenlet leírásával, valamint a Brønsted-Lowry sav és bázis címkézésével.,
-
azonosítsa a Brønsted-Lowry savat és bázist a következő kémiai egyenletben:
C3H7NH2(aq) + H3O+(aq) → c3h7nh3+(aq) + H2O(ℓ)
-
Ha a kodein-hidrobromidnak c18h22brno3 képlete van, mi az anyavegyület kodein képlete?,
írja be a kokain-hidroklorid (ℓ) esetén bekövetkező reakció kémiai egyenletét c17h22clno4) vízben oldódik, és egy protont adományoz egy vízmolekulának. (Amikor a hidroxidok vízben oldódnak, kloridionokká és megfelelő kationokká válnak.)