tanulási célok
- az ütközéselmélet megértéséhez.
- ahhoz, hogy megértsük a reakciósebességet befolyásoló négy fő tényezőt.
a Reakciókinetika a kémiai reakciók sebességének vizsgálata, és a reakciósebesség nagymértékben változhat az időskálák nagy tartományában. Egyes reakciók robbanásszerűen gyors ütemben folytatódhatnak, mint például a tűzijáték robbanása (17. ábra.,1 “tűzijáték éjszaka a folyó felett”), míg mások sok éven át lassú ütemben fordulhatnak elő, mint például az elemeknek kitett szögesdrót rozsdásodása (17.2″rozsdás szögesdrót” ábra).
17.1. Tűzijáték éjszaka a folyó felett

a tűzijáték kémiai reakciója robbanásveszélyes.
17.2. Rozsdás szögesdrót

a szögesdrót rozsdásodása sok év alatt megtörténik.,
Ütközéselmélet
a kémiai reakciók kinetikájának, valamint a kinetikát befolyásoló tényezőknek a megértéséhez először meg kell vizsgálnunk, mi történik a molekuláris szintű reakció során. A reaktivitás ütközési elmélete szerint a reakciók akkor fordulnak elő, amikor a reaktáns molekulák “hatékonyan ütköznek”.”Egy “hatékony ütközés” fordul elő, a reaktív molekulák kell kialakítani tér helyesen, hogy megkönnyítse a törés alkotó kötvények, valamint az átrendeződés az atomok, amelyek következtében a kialakulását termék molekulák (Ábra 17.3 “Ütközés Képi megjelenítés”).
17.3., Ütközés Vizualizációk
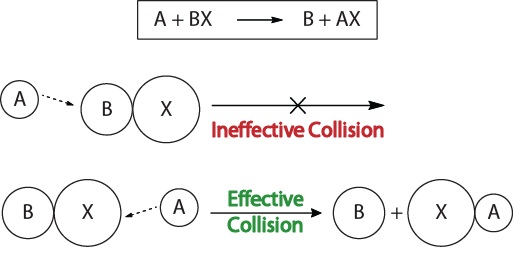
Ez a vizualizáció nem hatékony ütközést mutat molekuláris orientáció alapján.
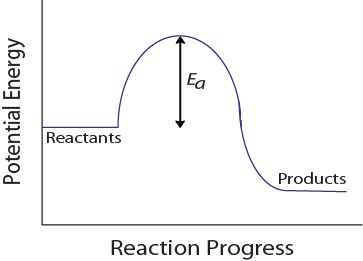
molekuláris ütközés során a molekuláknak minimális mennyiségű kinetikus energiával kell rendelkezniük a hatékony ütközés bekövetkezéséhez. Ez az energia változik minden egyes reakció, és ismert, mint az aktiválási energia (EA) (ábra 17.4 “potenciális energia és aktiválási energia”)., A reakció sebessége tehát az aktiválási energiától függ; a magasabb aktiválási energia azt jelenti, hogy kevesebb molekulának elegendő energiája lesz a hatékony ütközéshez.
17.4. Potenciális energia és aktiválási energia
olyan tényezők, amelyek befolyásolják a sebességet
négy fő tényező befolyásolhatja a kémiai reakció sebességét:
1. Reagens koncentráció., Egy vagy több reagens koncentrációjának növelése gyakran növeli a reakció sebességét. Ez azért fordul elő, mert a reaktáns magasabb koncentrációja egy adott időszakban több ütközést okoz a reagensnek.
2. A reagensek és a felület fizikai állapota. Ha a reaktáns molekulák különböző fázisokban léteznek, mint egy heterogén keverékben, akkor a reakció sebességét az érintkezésben lévő fázisok felülete korlátozza., Például, ha egy szilárd fémre reagáló és gázreaktáns keveredik, csak a fém felületén jelen lévő molekulák képesek ütközni a gázmolekulákkal. Ezért a fém felületének növelése, ha lapos vagy sok darabra vágja, növeli a reakciósebességet.
3. Hőmérséklet. A hőmérséklet emelkedése általában növeli a reakció sebességét. A hőmérséklet emelkedése növeli a reaktáns molekulák átlagos kinetikus energiáját., Ezért a molekulák nagyobb hányada rendelkezik a hatékony ütközéshez szükséges minimális energiával (ábra. 17,5 “hőmérséklet és reakciósebesség”).
ábra. 17,5 hőmérséklet és reakciósebesség
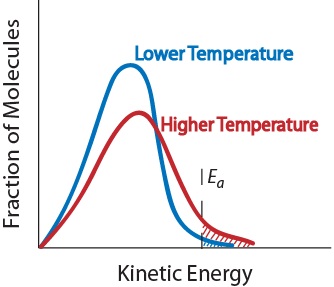
4. Katalizátor jelenléte. A katalizátor olyan anyag, amely felgyorsítja a reakciót azáltal, hogy részt vesz benne anélkül, hogy fogyasztaná. A katalizátorok alternatív reakcióútot biztosítanak a termékek előállításához., Számos biokémiai reakció szempontjából kritikusak. Ezeket tovább fogják vizsgálni a ” katalízis.”
Key Takeaways
- reakciók akkor fordulnak elő, amikor két reaktáns molekula hatékonyan ütközik, mindegyiknek minimális energiája és helyes orientációja van.
- A reagensek koncentrációja, a reagensek fizikai állapota, valamint a felület, a hőmérséklet és a katalizátor jelenléte a reakciósebességet befolyásoló négy fő tényező.