a Múlt hónapban meghívtak, hogy beszéljen a Központok a Mendeli Genomika (CMG) Elemzése, Módszerek Fejlesztési találkozó “Népesség-alapú becslés penetrance ritka betegség”. Itt van a blogbejegyzés változata a beszédem.
mi a penetrancia és miért érdekel minket?
a Penetrancia egy adott genotípus adott betegségének kialakulásának valószínűsége., Lehet beszélni az életkorfüggő penetranciáról, tehát a genotípussal rendelkező emberek százalékos aránya a betegséget 40 éves kor, 50 éves kor, és így tovább; általában az élethosszig tartó kockázat szempontjából beszélek, ami azt jelenti, hogy valószínű, hogy valaha is kialakul a betegség, mielőtt meghalsz. Ennek velejárója az, hogy a felnőttkori betegségek esetében az élettartam kockázata soha nem lehet 100%, mert először mindig meghalhat valami mástól.
A Penetrancia rendkívül fontos a prediktív genetikai tesztelésen átesett egyének számára — sok ember első kérdése: “ez azt jelenti, hogy biztosan megkapom a betegséget?”., Mégis gyakran nagyon nehéz, hogy jöjjön egy határozott becslést penetrance.
hagyományos módszerek becslésére penetrance
egy ideális világban, a helyes becslés penetrance lenne megállapítani, a születés, egy nagy kohorsz az emberek egy adott genotípus, kövesse őket, amíg az összes halt meg, vagy valami hasonló, de akkor kérdezd meg, hogy hány valaha kifejlesztett, a betegség előtt haltak meg. Mivel a genotipizálási technológiát kevesebb mint egy emberi életre találták fel, ezt soha nem tették meg semmilyen betegség esetén.
ehelyett a kutatók gyakran használnak család alapú módszereket a penetráció becslésére., Egy tipikus tanulmány mindenkit megvizsgálna, akit megfigyeltek az adott genotípussal, és megkérdezné, hogy hány dieáz van, vagy hányan vannak betegségben egy bizonyos korban. A családi alapú módszerek átfogó megállapítási elfogultságot szenvednek., megállapítható alapján bemutatja a betegség
Mint például az, hogy ez az utolsó pont, a genetikai prion betegség, csak 23% a veszélyeztetett emberek válassza ki a prediktív genetikai tesztelés , illetve a törzskönyv adatait, hogy már hozzáfért, tudtuk, hogy a genotípusok csak 22% – a veszélyeztetett egyének .,
a fent felsorolt összes tényező ugyanabba az irányba működik, hajlamos arra, hogy felfújja a penetrancia becslését.
A kutatók már régóta ismerik ezeket a problémákat, és javasoltak néhány megoldást. Például, a kin-kohorsz módszer magában foglalja annak ellenőrzése, egészséges egyének véletlenszerűen egy populáció genetikai őket, figyelembe véve a családi történelem, valamint összehasonlítása túlélési görbék az első fokú rokonok., Ez egy nagyon okos megoldás, de arra támaszkodik, hogy elegendő számú, betegséget okozó genotípussal rendelkező embert tud megállapítani anélkül, hogy megállapítaná a betegség jelenlétét. Így működött a BRCA1 és a BRCA2 változatok az amerikai Askenazi zsidók, de sok ritkább genetikai körülmények, ez nem praktikus, mert akkor kell toborozni több tíz vagy több százezer ember, hogy megtalálja még egy egyén egy genotípus az érdeklődés.,
populációs alapú módszerek
a fent leírt összes okból nagyon hasznos ortogonális, populációs alapú módszerek, a penetranciával kapcsolatos kérdések feltevésére. Az első kulcsfontosságú betekintés itt az, hogy egy teljesen behatoló genetikai változat nem lehet gyakoribb a populációban, mint az általa okozott betegség. Ennek a logikának a gyakorlatban történő alkalmazása azt jelenti, hogy jó becslésekre van szükség az allél gyakoriságáról még a ritka változatok esetében is, és ez a közelmúltig nehéz volt. ExAC, adatbázis genetikai variáció 60,706 emberi exomes, új lehetőségeket kínál ., Sok egyén pontosan megállapították, mint az esetek vagy ellenőrzések Különböző gyakori, komplex betegségek, de egyik sem állapították meg Mendelian betegség, így ExAC egy jó referencia adatbázis tanulmányozására legtöbb genetikai betegségek.
azáltal, hogy allélfrekvencia információt az általános népesség, ExAC, mint a korábbi referencia adatbázisok, mint például ESP, világossá tette, hogy a klinikai genetika egy nagy probléma: sok variánsok jelentett okozhat genetikai betegség valójában nem okoz genetikai betegség, vagy legalábbis nem a legtöbb időt.,
két adatbázis — a HGMD és a ClinVar-gyűjti a szakirodalomból és a klinikai laborokból származó állításokat, amelyek szerint egy adott genetikai változat egy adott genetikai betegséget okoz. Végül több mint 100 000 egyedi, betegséget okozó genetikai variáns szerepelt az adatbázisokban. Az átlagos személy ExAC 54 közülük . Nyilvánvaló, hogy az átlagembernek valójában nincs 54 genetikai betegsége., Természetesen ennek a feleslegnek a nagy részét kis számú vadul nagyfrekvenciás változat okozza, amelyek nyilvánvalóan nem okoznak genetikai betegséget,és ennek nagy része állítólag recesszív variánsok, amelyek pontosan heterozigóta állapotban találhatók. De még ha csak nézz változatok a domináns betegség géneket egy allél gyakorisága <1%, még mindig látom 0.89 értesülések szerint a kórokozó változatok személyenként , de nyilvánvalóan nem ez a helyzet, hogy a ~90% – a domináns genetikai betegség., Tehát az allél frekvenciaspektrumán keresztül sok állítólag patogén változat létezik, amelyek nem annyira patogének. Amikor Anne O ‘ donnell, majd megnéztem a értesülések szerint a kórokozó változatok a legmagasabb allél-gyakoriságok a ExAC, majd megkérdezte, hogyan sikerült, hogy általam elküldött helytelenül besorolt, mint patogén, azt találtuk, hogy a legtöbb időt a probléma nyomon követhető, hogy a papír, a szakirodalom, hogy volna igény a patogenitási elégtelen bizonyíték alapján.
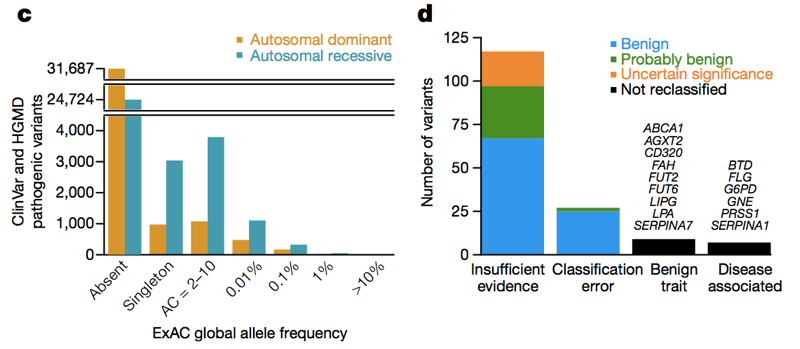
fenti: 3C. és 3D., Az allél frekvenciaspektrumán és mind a domináns, mind a recesszív betegséggénekben sok állítólag patogén változat jelenik meg pontosan. A magas (>1%) frekvencia állítólag patogén változatok, néhány valóban patogén, néhány valóban tulajdonsággal társított, de a tulajdonság jóindulatú, és néhány a Megjegyzések hibái az adatbázisokban — de a többség az elégtelen bizonyítékokkal rendelkező irodalomra épül.,
az ExAC-ból származó Allélfrekvencia-információk lehetővé tették több mint 200 genetikai változat átsorolását patogénről jóindulatú, valószínűleg jóindulatú vagy bizonytalan jelentőségű . Az ilyen típusú átsorolások néha visszalépést váltanak ki az eredeti szerzőktől, akik azt javasolták, hogy egy változat genetikai betegséget okoz, akik azzal érvelhetnek, hogy egy változat továbbra is patogén lehet, de hiányos penetrációval. De mennyire lehet” hiányos ” a hiányos penetráció?, Kvantitatívnak kell lennünk, mert ha az élettartam kockázata legfeljebb 1%, akkor még mindig ésszerű azt mondani, hogy egy változat “genetikai betegséget okoz”, vagy “patogén”? Míg a allél gyakorisága az információ soha nem bizonyítja, hogy az a változat nem egyesület, hogy a betegség nem tud határt, hogy mi a lehetséges penetrance lehet, de sok esetben még meglehetősen ritka változatok, lehetséges, hogy azt mutatják, hogy nem létezik, hogy egy változatot biztosít a kockázati szint bárhol távolról közel 100% – os.,
ahhoz, hogy kvantitatív legyen, ki kell terjesztenünk korábbi megfigyelésünket — hogy egy teljesen penetráns genetikai változat nem lehet gyakoribb a populációban, mint az általa okozott betegség. Ez mind egyszerű matematikai és populációs genetika, de túl gyakran nem alkalmazzák a gyakorlatban. Kétféleképpen gondolhatunk az allél gyakoriságára, amikor következtetéseket vonunk le a patogenitásról és a penetranciáról.
maximális hiteles allélfrekvencia
mondja, hogy egy Mendeliai betegségben szenvedő beteg exómáját vizsgálja, és megpróbálja azonosítani az okozati változatot., Kollégám, James Ware kidolgozott egy stratégiát az exome szűrésére az allélfrekvencia-információkkal szemben, kihasználva a következő logikát., A maximális allél gyakoriság, hogy hihető az, hogy egy változó kell, mert egy domináns genetikai betegség egyenlő a betegség prevalenciája alkalommal a allélikus heterogén (esetek arányának tulajdonítható, hogy az egyik variáns) osztva penetrance (kevesebb áthatoló változatok lehet gyakoribb), osztva 2 (mert mi vagyunk a diploid):
\
például A prion betegség okai az 1-ben 5000 halálesetek, valamint a leggyakoribb változat (E200K) található 5% – ában , tehát 100% – os penetrációs változat nem lehet allél gyakorisága nagyobb, mint 0.0005% (1 200,000) ., A kardiomiopátia 500 beteg közül 1-et érint, a leggyakoribb változat a <2% – ában található, így az 50% – os penetráns variánsnak nem lehet 0,004% – nál nagyobb allélfrekvenciája . A recesszív betegségek képlete egy fokkal bonyolultabb, de James is kidolgozta, és leírja .
tehát míg a történelmileg az emberek gyakran kiszűrték a variánsokat allélfrekvenciával > 0.1% amikor megpróbálják azonosítani a domináns betegség okait , valójában sokkal szigorúbbak lehetünk., A figyelmeztetés az, hogy alacsony allélszám esetén az allél frekvenciájának becslésére való képességünket a mintavételi variancia korlátozza. Például, ha megnézzük az ESP-ben az európaiak körében 1% – os allélfrekvencián látható változatokat, akkor ezeknek a változatoknak körülbelül 1% – os gyakoriságuk van az ExAC európaiak körében. De az ESP-ben 0,1% – os frekvenciájú változatok ExAC-ban általában kissé ritkábbak, és a legtöbb szingleton (az ESP-ben pontosan egyszer látott változatok) nem jelenik meg újra másodszor.
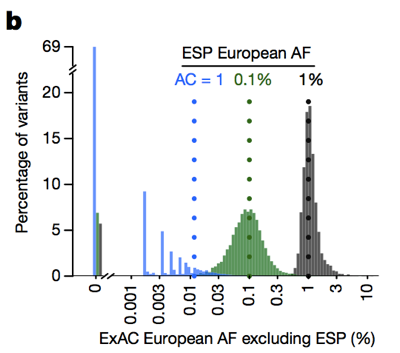
felett: ábra 3B-tól . Minél alacsonyabb az allélszám, annál kevésbé jó az allélfrekvencia becslése.,
ezért minél alacsonyabb az allélszám, annál konzervatívabbnak kell lennünk. Kidolgoztunk egy keretet erre a 95% felső határ a Poisson eloszlást, hogy hány allél lehet megfigyelni egy adott frekvencián, és előre kiszámított értékek minden ExAC (elérhető FTP), hogy lehet használni-tudjon meg többet a módszerek . James is létrehozta ezt a praktikus webes alkalmazás, amely lehetővé teszi, hogy vizsgálja meg, mi a “maximális hiteles allél frekvencia” legyen a betegség az érdeklődés.,
velejárója ez a megközelítés, hogy minél alacsonyabb a penetráció egy variáns, annál nagyobb gyakorisággal lehet az általános népesség. De azt is kitalálnia kell, hogy ha a penetráció meglehetősen alacsony, mondjuk kevesebb, mint 10%, akkor ennek a változatnak a klinikai hasznossága is alacsony. James Nicky Whiffin ismertetett adatok azt mutatják, hogy szinte minden klinikai hasznosságát szekvenálás a cardiomyopathia származik változatok gyakorisággal <0.001% — gyakoribb változatok együttesen járulnak hozzá, ha kicsit is kockázatos .,
az élettartam-kockázat becslése és határai
ne feledje, hogy a penetrancia egy adott genotípus esetén a betegség valószínűsége. Vagy, ha figyelembe vesszük az allél helyett genotípusos modell, a valószínűsége a betegség adott egy adott allél. Ezt P(D|A) – ként írhatjuk. Miután ezt megtettük, világossá válik, hogy Bayes tételével
\
mindegyik kifejezésnek van egy sajátos jelentése:
itt vegye figyelembe, hogy a “populációs kontrollok” olyan csoportot jelentenek, amelyet nem választottak ki a betegség jelenlétére vagy hiányára. Csak egy szelet a lakosság.
So:
\
Ez a logika semmi új., A Bayes-tétel használata a betegség kockázatának becslésére legalább a dohányosok rákkockázatának becslésére nyúlik vissza, és a genetikára való alkalmazását majdnem olyan hosszú ideig fontolóra vették . De ahhoz, hogy ez az egyenlet működjön a ritka betegségek esetében, elég jó becslésekre van szükség az eset – és népességszabályozási allél gyakoriságáról, és ezeket a közelmúltig nehéz volt elérni. Tehát az ExAC-nak köszönhetően egyre több olyan helyzet van, ahol ez az egyenlet releváns.
itt van az R kód, amelyet írtam (eredetileg itt) a penetrancia becslésére ezen képlet alapján.,
ha nem akarja saját maga futtatni az R kódot, James Ware végrehajtotta ezt a webes alkalmazás” penetrance ” fülén, így csak csatlakoztathatja számait a böngészőbe.
annak érdekében, hogy megbecsüljük a 95% – os konfidencia intervallumok penetrance, elfogadtam a megközelítés . A bemenet a allél gróf (AC), valamint az egyedszám (N) az esetekben, ellenőrzések, valamint a felső határ a 95% – os CI alapján számítják ki a felső 95% – os CI a binomiális eloszlás az esetben allél gyakorisága, az alsó 95%CI szabályozza., Ezzel szemben a penetrancia alsó határa az eset allél frekvenciájának alsó határán és a kontroll allél frekvenciájának felső határán alapul. Joggal vitathatja, hogy mivel ez a képlet mindkét allélfrekvencia-értéken 95% CIs-t használ, az így kapott konfidencia-intervallumok nagyobbak, mint amilyennek lennie kellene. Azt is helyesen quibble, hogy a binomiális eloszlás nem egy jó becslés alacsony allélszám, mivel a torzítás ábrán látható 3b fent látható (és én biztosan soha nem alkalmazza ezt a képletet singletons-változatok megfigyelt csak egyszer ExAC)., De a végén a nap, okokból fogok beszélni közelebb a végén ezt a bejegyzést, ez a képlet valóban a legjobban használt megszerzésére Stadion, nagyságrenddel becsült penetrance. Ha keres egy rendkívül pontos pont becslés penetrance, ez az egész megközelítés valószínűleg nem fog működni az Ön számára egyébként.
ha átrendezi az egyenletet, akkor egy másik módja annak, hogy gondolkodjunk rajta:
\
Ez azt jelenti, hogy a genotípusú emberek körében a megnövekedett kockázat arányos az eset és a populációs kontroll allél gyakoriságának arányával., Tehát egy olyan változat, amely 200-szor növeli a kockázatot, 200-szor gyakoribb az esetek között, mint az általános népességben. (Vegye figyelembe, hogy ez az arány az allél frekvenciák kissé eltér odds arány bár a két intézkedés konvergálnak Nagyon ritka változatok.)
alkalmazás a prion-betegségre
ezt a logikát egy év elején közzétett tanulmányban vettük át, számszerűsítve a prion-betegség variánsok penetrációját ., Személyes okból érdekel a prion-betegség-a feleségem kórokozó változatot hordoz a PRNP-ben—, de kiderül, hogy a prion-betegség szintén nagyszerű teszt eset a fenti logika becslésére a penetráció becslésére. Az ExAC V1-ben lévő egyének egyikét sem állapították meg neurodegeneratív betegség esetén, tehát az ExAC valóban jó populációellenőrzési adatkészlet a prion-betegség esetében. Mivel a prionbetegségek “bejelenthetők”, a nemzeti felügyeleti központok kivételesen jó esetmegállapítással rendelkeznek, és az adatok megosztásának nagylelkűségének köszönhetően 10 460 szekvenált esetet tudtunk felhalmozni.,
megállapítottuk, hogy a>60 variáns, amelyekről a prion-betegséget kumulatív módon jelentették, 52 allélja van ExAC-ban. Ez azt jelenti, hogy 1000 emberből csaknem 1-nek van ilyen változata, és így ezek a változatok halmozottan sokkal gyakoribbak, mint az összes prion-betegség (ami 5000 haláleset esetén ~1-et okoz), nem is beszélve az összes genetikai prion-betegségről (az esetek mindössze ~15% – a genetikai). Ez elég ahhoz, hogy elmondja nekünk, hogy nem minden ilyen változat lehet teljesen behatolni. Annak érdekében, hogy meghatározzuk, mely változatok voltak a bűnösök, összehasonlítottuk az esetsorozatot., A patogenitásra kiváló előzetes bizonyítékkal rendelkező variánsok (Mendeliai szegregáció és egérmodellek) gyakoriak voltak az esetekben, és hiányoztak az ExAC-ból, összhangban a teljes vagy közel teljes penetrációval. A túlzott allélszám nagy részét ExAC-ban olyan variánsok adták, amelyek ritkán fordultak elő az esetekben, és gyenge volt a patogenitás előzetes bizonyítéka — ezek a variánsok valószínűleg jóindulatúak, vagy csak alacsony kockázattal járulnak hozzá. Legalább három változat köztes volt, mivel túlságosan gyakoriak voltak a teljes penetráció ellenőrzésében,mégis még mindig gazdagodtak az ellenőrzések során.,
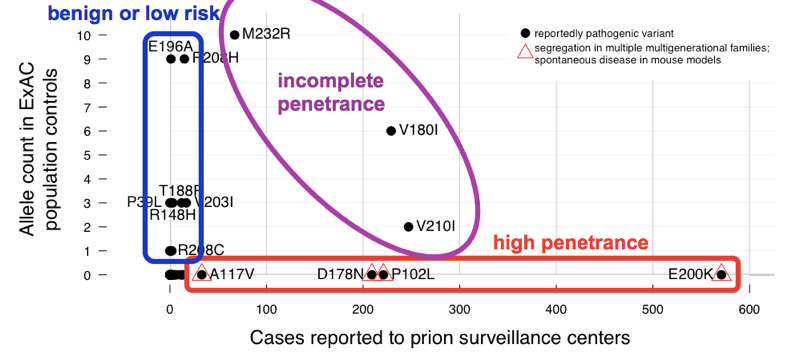
felett: egy annotált változata ábra 2-tól .
amikor a fenti P(D|A) képlet segítségével becsültük meg az egyes változatok penetranciáját, azt találtuk, hogy a prnp változatok penetranciájának teljes spektruma van.
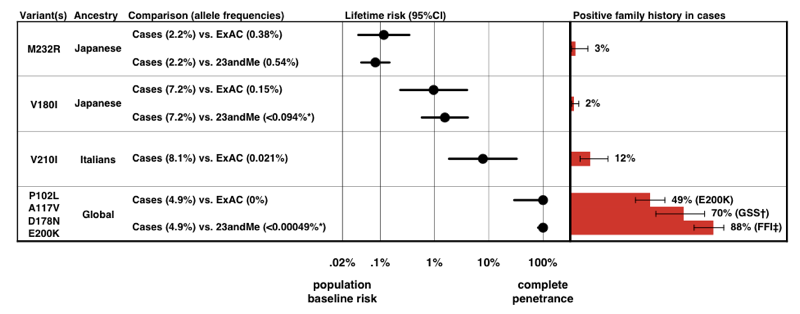
felett: ábra 3-tól .
vegye figyelembe az X tengely skáláját-olyan ritka betegség esetén, hogy annak kialakulásának előzetes valószínűsége csak 0, 02%, még a kockázat 50-szeres növekedése is csak 1% – os élettartam-kockázat., Megnyugtató módon, a penetrance becslése szerint egyedül az allélfrekvencia-információból származunk, elég jól összhangban a pozitív családtörténettel rendelkező esetek arányával.
Ez a munka már vezetett a prognózis változásához néhány olyan személy esetében, akiknek eredetileg azt tanácsolták, hogy veszélyeztetik a magas penetrációs variánsokat — lásd és Erika Check Hayden cikkét Az Exacról. Erről a tanulmányról itt olvashatja el Sonia és én személyes utazását.,
az nr1h3
sclerosis multiplex (MS)egy összetett betegség, számos genetikai kockázati tényezővel, de a betegség Mendeliai formája nem ismert. Az év elején egy tanulmány arról számolt be, hogy egy nukleáris hormonreceptor missense változata — NR1H3 R415Q — okozza az SM első Mendeliai formáját . Ezt az állítást alapján domináns szegregáció a betegség, a két család, de a LOD pontszám volt, csak 2.2 — a küszöbérték alatt a genom-wide jelentősége a családi kapcsolat tanulmányok, ami több, mint 3.0 vagy 3.6 . A szóban forgó változat allélfrekvenciája 0.,031% a nem Finn európaiaknál. Ez nem úgy hangzik, mint egy magas allélfrekvencia, de kiderül, hogy túl magas ahhoz, hogy ez a változat Mendelian MS-t okozzon .
úgy vélik, hogy a MS-nek (az általános populációban) a nők esetében 0, 25% – os, a férfiaknál pedig 0, 14% – os élethosszig tartó kockázata van . Ha 0.06% – a az általános népesség R415Q heterozigóta, ha még fél velük ment, hogy fejleszteni MS, akkor ez a változat egyedül megmagyarázza a 0,03% – a a lakosság fejlődő MS Szóval, ha egy teljes 0,25% – a, akik fejleszteni MS, akkor 12% – uk kellett volna ez a változat., Ehelyett a változatot csak 2053 MS betegből álló esetsorból 1 egyénnél találták meg .
Ez 0, 024% – os allélfrekvenciára, vagy 0, 049% – ra működik, ha 2 esetet engedélyezünk az esetsorozatban. Ez nem szignifikánsan magasabb, mint a pontos frekvencia. De ha ez a változat MS-t okoz, akkor gyakoribbnak kell lennie az esetekben — sokkal gyakoribbnak. Emlékezz az átrendezett képletünkre korábban: P (D / A)|P(D) = P(A/D) / P(A). Ez azt jelenti, hogy ha EGY változat X-szeresére növeli a kockázatot, akkor a kontrollokban X-szer gyakrabban kell lennie. Tehát, ha az MS kiindulási kockázata 0.,25% , Ez a változat 50% penetráns, 50/ – nek kell lennie.25 = 200-szor gyakoribb esetekben, mint a kontrollok. Ha még 10% penetranciája is volt, akkor még mindig 10/ – nek kell lennie.25 = 40-szer gyakoribb az esetekben, mint a kontrollokban. Alternatív megoldásként a valószínűségek helyett az esélyarányok tekintetében is gondolkodhat. A 0,25% – os élettartam-kockázat a lakosság körében 1:399 szorzót jelent, és ha az R415Q 50% – os élettartam-kockázatot jelent, az 50:50 esély. (50/50)/(1/399) = 399, tehát az r415q esélyarányának 399-nek kell lennie ahhoz, hogy ez a változat 50% penetranciával rendelkezzen.,
ehelyett, ha a képletet a korábbi r-kóddal alkalmazzuk, 0,25% kiindulási kockázatot feltételezve, és a számítást 2 053 esetben 2 allélra alapozzuk, szemben a 33 369 ExAC egyén 21 alléljával, azt találjuk, hogy a penetrance 95% – os CI felső határa 2,2%. Tehát még akkor is, ha az R415Q társult az MS kockázattal, nem tudott több mint 2.2% – os élethosszig tartó kockázatot biztosítani az MS kialakulására .,
hivatalos válaszukban és a PubMed Commonsban a szerzők összehasonlították az Lrrk2 G2019s-t a Parkinson-kórban, amely mindenki egyetért azzal, hogy patogén, de pontosan megtalálható, és csak szerény esélyaránnyal rendelkezik, becslések szerint 9, 6 . Ehhez a változathoz a matematika működik. A Parkinson-kór legalább nagyságrenddel gyakoribb, mint az SM, az élettartam kockázata bárhol 3, 7% – ról 6, 7% – ra becsülhető . Ez a nagyságrenddel nagyobb prevalencia azt jelenti, hogy a megfigyelt ~10-szeres dúsítás — az LRRK2 G2019S körülbelül 0-ban található.,A kontrollok 1% — A és az esetek 1% – A nagyjából megfelel a Parkinson-kór által jelentett ~32% – os élettartam-kockázatnak . Ezek a kvantitatív részletek számítanak, és minden variáns és betegség esetében eltérőek. Ezért hasznosak az ebben a bejegyzésben tárgyalt képletek, annak ellenére, hogy csak nagyon durva becsléseket nyújtanak, és több figyelmeztetés van kitéve, amint azt az alábbiakban ismertetjük.
mindkét fent leírt alkalmazásban az allélfrekvencia-információkat használták a penetrancia durva becslésére., A prion-kórban meg tudtuk mutatni, hogy a korábban erősen penetránsnak vélt változatok 0,1% – os, 1% – os vagy 10% – os életkockázatot eredményeztek. Az NR1H3 történetben az allélfrekvencia-információ elegendő volt ahhoz, hogy megmutassa, hogy a állítólag okozati változat nem képes több mint néhány százalékos élettartam-kockázatot biztosítani.
de az allélfrekvencia-adatok használata a penetrancia szigorúbb becsléséhez nagyon nehéz lenne. Például a családi alapú tanulmányok nem értettek egyet a prnp E200K behatolásával kapcsolatban, a becslések 60% – tól 90% – ig terjednek ., Mivel a prion tanulmány jött ki, volt néhány ember E200K családok kérdezni, hogy a pontos adatok segíthetnek szűkíteni, ahol a kockázat ezen a tartományon belül. A válasz, sajnos, nem lehet.
Itt vannak a legfontosabb oka, miért hiszem, minden penetrance becslések alapján allél gyakorisága kell venni egy csipet só:
- Ha egy változat erősen áthatoló, akkor nehéz ahhoz, hogy egy esetben sorozat, amely nem tartalmaz kapcsolódó egyének. Ha a case sorozat relateds, akkor technikailag még nem kapott elfogulatlan becslés P (A|D).,
- ha egy betegség végzetes, akkor nehéz olyan populációs kontroll sorozatot szerezni, amely legalább kissé kimerült az ilyen betegséget okozó variánsokkal rendelkező emberektől. Tehát akkor nincs elfogulatlan becslés A P (A) – ról sem.
- Az eset és a kontroll allél gyakoriságának összehasonlítása érzékeny a populációs rétegződés zavaraira. A prion-vizsgálatban nem rendelkeztünk genomra kiterjedő SNP-adatokkal az esetekről, így nem volt mód arra, hogy tökéletesen ellenőrizzük ezt.,
- Sok ok-okozati változatok a ritka betegségek olyan ritka, hogy még ExAC, még nem kellően pontos becslések allél gyakorisága adni jobb, mint a kemény válasz.
mindezek mellett a populációalapú allélfrekvencia-becslés még mindig jó módja annak, hogy durva nagyságrendű becsléseket kapjunk a penetranciáról, és ellenőrizzük, hogy egy genetikai változat valószínűleg okozati lehet-e egy ritka betegség esetében.