Kategória: kémia
megjelent: December 9, 2013
igen, a víz nulla Celsius fok alatt maradhat. Van néhány módja annak, hogy ez megtörténhet.
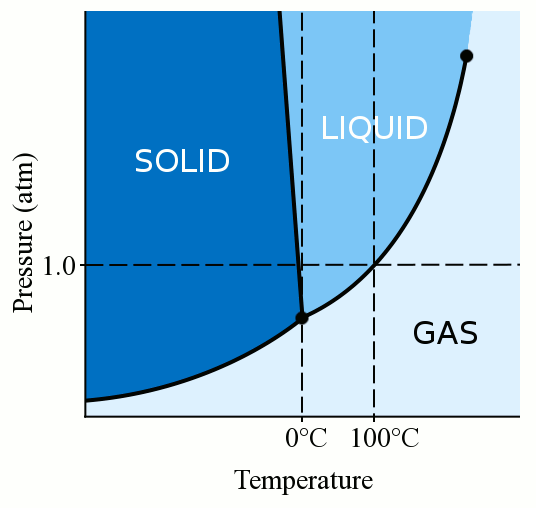
mindenekelőtt az anyag fázisa (legyen az gáz, folyadék vagy szilárd) erősen függ mind a hőmérsékletétől, mind a nyomásától., A legtöbb folyadék esetében a nyomás alkalmazása növeli azt a hőmérsékletet, amelyen a folyadék szilárdra fagy. Szilárd anyag keletkezik, amikor egy folyadék laza, kanyargós molekulái elég lassúak és elég közel vannak ahhoz, hogy stabil kötéseket képezzenek, amelyek a helyükre rögzítik őket. Amikor nyomást gyakorolunk egy folyadékra, arra kényszerítjük a molekulákat, hogy közelebb kerüljenek egymáshoz. Ezért stabil kötéseket képezhetnek, és szilárdakká válhatnak, még akkor is, ha magasabb hőmérsékletük van, mint a normál nyomáson lévő fagyáspont. A víz azonban kissé egyedi. A vízmolekulák szétterülnek, amikor szilárd kristályszerkezetbe kötődnek., Ez terjed ki cselekvés vezet a jég, hogy kevésbé sűrű, mint a folyékony víz, ami a jég úszik. A vízmolekuláknak a fagyasztás során történő elterjedése azt is jelenti, hogy a vízre gyakorolt nyomás csökkenti a fagyáspontot. Ha elegendő nyomást alkalmaz (ami megnehezíti a vízmolekulák szilárd szerkezetbe történő elterjedését), akkor a folyékony víz több fokkal nulla Celsius fok alatt lehet.
még akkor is, ha nem alkalmaz nyomást, még mindig lehet folyékony víz nulla alatti hőmérsékleten adalékanyagokkal., Az olyan adalékanyagok, mint a só, zavarhatják a szilárd anyag kialakításához szükséges kémiai kötést, ezért csökkenthetik a víz fagyáspontját. A só erős nátrium-és klórionokból áll. Vízben oldva a vízmolekulák hajlamosak egymás helyett a sóionokhoz ragaszkodni, ezért nem fagynak le olyan könnyen. Ahogy több sót adunk a vízhez, a fagypont továbbra is csökken, amíg a víz el nem éri a telítettséget, és nem tud több sót tartani. Ha elegendő sót ad hozzá, a víz fagyáspontja -21 Celsius fokig csökkenhet., Ez a tény azt jelenti, hogy a -21 Celsius fokos víz továbbra is folyékony maradhat, ha elegendő sót adnak hozzá. Ahelyett, hogy a folyékony vizet a fagyasztástól tartanák, ez a só erőteljes tulajdonsága arra is felhasználható, hogy a jeget vízbe fordítsa. A jeges járdákon a só permetezése csökkenti a jég fagypontját a környezeti hőmérséklet alatt, a jég pedig megolvad. De a só jeges járdákon történő permetezése nem segít, ha a környezeti hőmérséklet -21 Celsius fok alatt van. A só hatása a víz fagypontjára is mély hatással van a föld óceánjaira.,
még akkor is, ha nem alkalmaz nyomást, és nem ad hozzá semmit a vízhez, akkor is lehet folyékony víz nulla Celsius fok alatti hőmérsékleten. Annak érdekében, hogy a víz jégre fagyjon, szüksége van valamire, amire fagyhat a folyamat elindításához. Ezeket a kiindulási pontokat “nukleációs központoknak”nevezzük. A legtöbb esetben egy kis por, szennyeződés vagy akár kevés rezgés a vízben nukleációs központokat biztosít a víz befagyásához. De ha a víz nagyon tiszta és nagyon csendes, nincs semmi, amire a vízmolekulák kristályosodnának., Ennek eredményeképpen a nagyon tiszta vizet jóval nulla Celsius fok alatt hűtheti fagyasztás nélkül. A víz ebben az állapotban “túlhűtött”. Normál nyomáson a tiszta víz akár -40 Celsius fokig is túlhűthető. A túlhűtött vizet csak a nukleációs központok hiánya tartja fenn a fagyasztástól. Ezért, ha a nukleációs központok rendelkezésre állnak (ami ugyanolyan egyszerű lehet, mint a rezgés), a túlhűtött víz gyorsan lefagy. A fagyos eső a túlhűtött folyékony víz természetes példája., Amint a fagyos eső eléri a Föld felszínén lévő tárgyat, az objektum nukleációs központokat biztosít,az eső pedig jégre fagy.
témák: fagyasztás, fagypont, fagyás eső, jég, fázisdiagram, nyomás, túlhűtött, hőmérséklet, víz