eddig megvizsgáltuk, hogy az atomi pályák párjai hogyan kombinálhatók molekuláris pályák kialakításához — kötések kialakításához. Ahogy azt gondoljuk, hogy az atompályák előrehaladása a legalacsonyabb energiától a legmagasabbig (1s, 2s, 2p, 3s…), ezeket a molekuláris pályákat energiájuk sorrendjében tudjuk megszervezni.
nagymértékben az energiában lévő molekuláris pályák sorrendje tekinthető annak az atomi pályának a sorrendjéből, ahonnan felépítették őket., Van néhány eltérés a szabálytól, néha, de ez a legegyszerűbb hely a kezdéshez. Tehát egy molekulában a legalacsonyabb energiájú molekuláris pályák a legalacsonyabb energiájú atomi pályákból, az 1s pályákból képződnek.
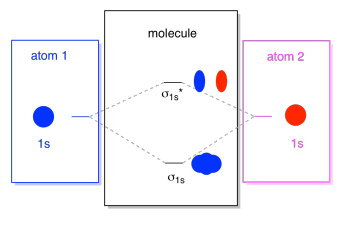
amit itt látunk, egy molekuláris orbitális interakciós diagram. A diagram közepe csak a molekuláris orbitális energia diagram. Ez Analóg az atomic orbital energy diagram (ami megy 1s, 2s, 2p, 3s…). Az energia sorrendje eddig σ1s, σ1s*., A diagram oldalai csak arra utalnak, ahonnan ezek a molekuláris pályák származtak, pontozott vonalakkal, hogy egyik helyről a másikra vezessenek. Összességében a kép azt mondja, hogy az egyik atomon az 1s orbitális, a másikon az 1s orbitális két különböző módon kombinálható, az alacsonyabb energiájú, a σ1s kötésű és a magasabb energiájú, anti-bonding σ1s*.
vegye figyelembe, hogy még nem adtunk hozzá elektronokat a molekuláris orbitális energia diagramhoz, de amikor megtesszük, csak alulról felfelé töltjük be őket, csakúgy, mint egy atomic orbital energy diagramot.,
az atomi pályák következő legalacsonyabb halmaza a 2s szint. Ezek a gömb alakú pályák nagyon hasonlítanának az 1s pályákhoz, és hasonló diagramot kapnánk, csak valamivel magasabb energiaszinten.
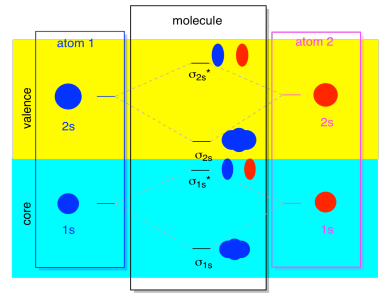
Az idő nagy részében nem fogjuk látni mind a σ1-eket, mind a σ2-ket az ábrán. Ennek oka az, hogy ha vannak 2s elektronok, akkor ezek az 1s elektronok valóban magelektronok, nem pedig valenciák. Egy kicsit mélyebben vannak eltemetve az atomban, és nem játszanak nagyon fontos szerepet a kötésben., A magelektronok figyelmen kívül hagyása meglehetősen gyakori; ha emlékszel, az atomelektron-konfigurációkban az 1s22s22p4 helyett 2s22p4-et írhatunk oxigénre; figyelmen kívül hagytuk a magot. Amikor Lewis struktúrákat rajzoltunk, hat elektront adtunk oxigénnek, nem pedig nyolcat; figyelmen kívül hagytuk a magot.
A Mo összefüggésében tegyük fel, hogy van 2S elektron. Ez azt jelenti, hogy minden atomnak két 1s elektronja van, összesen négy. Amikor ez a négy elektron alulról felfelé töltődik be a Mo diagramba, akkor mind a σ1s kötést, mind az antibonding σ1s* – t elfoglalják., Mindkét elfoglalt kombináció hatása a kötés megszüntetése; ez a két pár elektron nem tapad. Így figyelmen kívül hagyhatjuk őket, és nem igazán hagyunk ki semmit.
a 2s pályák nem az egyetlenek a második héjban. Vannak 2p pályák is. Ne feledje, Van egy pár nagyon különböző módon, amelyben a P pályák kombinálhatók egymással, attól függően, hogy melyik tengelyen fekszenek. Ha nem fekszenek egymással párhuzamosan – vagyis ha merőlegesek egymásra, például px-re és py-re -, akkor egyáltalán nem tudnak kölcsönhatásba lépni egymással., Az egyik atom pz-je kölcsönhatásba léphet a másik atom pz-jével, azonban, mert párhuzamosak egymással.
általában a z tengelyt úgy határozzuk meg, hogy a két atom közötti vonal mentén fekszik. Két pz elektronpályák hazudna végig, hogy a tengely, mindegyik egy lebeny, amely belenyúlik a tér között az atomok, illetve minden más lebeny kiterjesztése el, a másik irányba
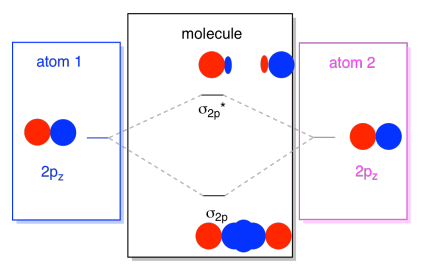
Az eredmény kombináció úgynevezett σ, mert hazugság a tengely mentén között az atomok (pontosan σ azt jelenti, tekintve, hogy a kötés)., Van egy σ kombináció, ha az átfedő lebenyek fázisban vannak egymással, és σ * kombináció, ha ezek a lebenyek fázison kívül vannak egymással. Mivel ezek az új pályák az atomi 2P pályákból származnak, hívjuk őket σ2p és σ2p*.
vannak olyan P pályák is, amelyek nem fekszenek a kötési tengely mentén, vagy a két atom közötti tengelyen. A px pályák merőlegesek az éppen nézett pz pályákra, ezért merőlegesek a kötések közötti tengelyre. Azonban még mindig párhuzamosak egymással, és még mindig kombinációkat képezhetnek., Ez a két pálya egy fáziskombinációt és egy fázison kívüli kombinációt képezne.
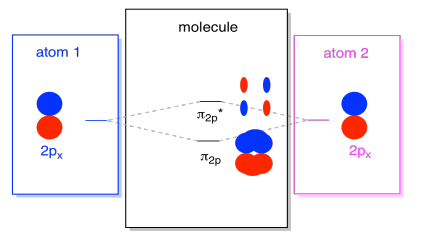
vegye figyelembe, hogy a két kombináció közötti energetikai elválasztás kissé kisebb, mint a σ2p és σ2p* szintek közötti rés. A különbség az atomi pályák közötti átfedés mértékéhez kapcsolódik. Az on-axis orbitals erősen ugyanabba a térbe vetül; sokat átfedésben vannak, és erősen kölcsönhatásba lépnek. A tengelyen kívüli pályák egymással szemben helyezkednek el, kevésbé erősen kölcsönhatásba lépnek, és kisebb energetikai változásokat eredményeznek., Az n2p orbitális és az n2p* orbitális közötti rés tehát jóval kisebb, mint a σ2p és σ2p* orbitálok közötti rés.
valójában kettő van a tengelyen kívüli p pályákból. A px készlet mellett lenne egy py készletünk is. Ha a px-készlet a képernyő síkjában van,akkor a py-készletnek egy orbitális kilógása van elöl, egy pedig mögött. Mindazonáltal a két py orbitális kombináció pontosan ugyanaz, mint amit a két px orbitális között láttunk. Csak a PX kombinációkhoz képest merőleges síkra forgatják őket.,
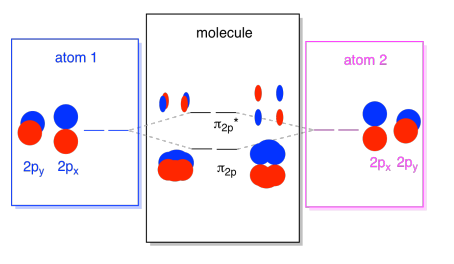
ezeket a 2p-alapú pályákat egy diagramba állíthatjuk össze. Kezd kicsit zsúfoltabbá válni, de ez a diagram csak a már látott darabok kombinációja. Vegye figyelembe, hogy a px, py, valamint pz atomi elektronpályák elején még ugyanabban az energia (van egymásra őket, így mindig látom az összefüggést az atomi, molekuláris elektronpályák). Ez azt jelenti, hogy az n2p & n2p* orbitals lesz “beágyazott” között σ2p & σ2p* orbitals.,
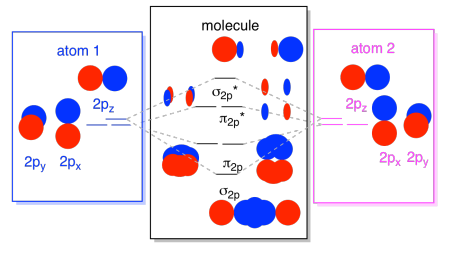
végül, szem előtt tartva, hogy a 2p pályák nagyobb energiában vannak, mint a 2s pályák, ezeket a képeket egy diagramba kombinálhatjuk. Ismét láttuk ezeket az egyedi darabokat korábban; most csak összeszereljük őket.
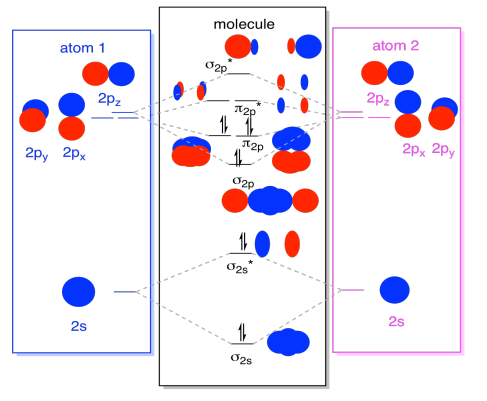
amíg rajta vagyunk, felvehetjük az elektronokat. Hogyan? Ez csak a valence elektronok teljes száma. Például az N2-t használtuk., Minden nitrogénnek öt valence elektronja van, összesen tíz, tehát éppen tíz elektronot töltöttünk be, kezdve a molekuláris orbitális energiaszint diagram alján. Ha ez egy másik molekula lenne, mint például az F2 vagy az O2, akkor a teljes diagramot hasonló módon állítanánk össze, de csak eltérő számú elektronot használnánk.
a fent leírt orbitális kép valójában csak egy potenciális kép a dinitrogén (és bármely más főcsoport vagy p-blokk diatomikus) elektronikus szerkezetéről., Nem kapunk valódi képet dinitrogén szerkezetéről, amíg nem töltjük fel ezeket a potenciális szinteket elektronokkal.
- csak az elektronokkal rendelkező energiaszintek befolyásolják a molekula energiáját (és viselkedését).
más szóval, az elektronok energiája határozza meg a molekula viselkedését. A többi energiaszint csak olyan lehetőségek, amelyek nem teljesülnek.
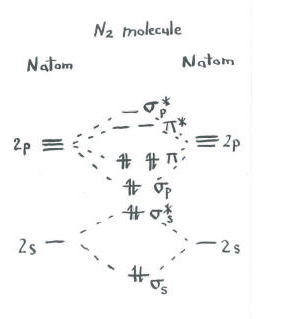
Gondolj a dinitrogén képére.
- minden nitrogénnek öt vegyértékű elektronja van.
- összesen tíz elektron van.,
- mindegyik kettő az S és S * antibonding szintekbe kerül. Ne feledje, ezeket egyszerűsítésként elkülönítettük a p készlettől.
- mindegyik kettő az s P kötésbe és a P kötési szintek mindegyikébe kerül.
a fennmaradó pályák (S P* antibonding és mindegyik p * antibonding szint) nincsenek elfoglalva. Ezek olyan képzeletbeli szintek, amelyek nem játszanak szerepet a dinitrogén energiájának meghatározásában. Egy igazi molekuláris orbitális számítás során az ilyen szinteken lévő elektronok hozzájárulnának a molekula általános energiájához.,
további információkat kapunk erről a képről. Például láthatjuk a kötési sorrendet a dinitrogénben.
- a kötési sorrend csak az atompár közötti kötések száma.
- a kötési sorrend egyike azon számos tényezőnek, amelyek befolyásolják a kovalens kötés erősségét.
- minél magasabb a kötési sorrend, annál több elektron oszlik meg az atomok között, annál erősebb a kötés.
a dinitrogénben az S S S S* antibonding szintek megszakítják egymást. Az egyik pár alacsonyabb az energiában, mint az atomban, de a másik magasabb., Az energia nettó csökkentése nincs. Ezek az elektronok nem járulnak hozzá a nitrogén-nitrogén kötés. Ezek nem kötődő elektronpárok.
az S P kötésben lévő hat elektron és a P kötési szintek azonban a szabad nitrogénatomok energiaszintjeiből származó energia csökkenését jelentik. Ez a három, alacsony energiájú elektronpár három kötést jelez a nitrogénatomok között.
ne feledjük, hogy néhány rövid vágást végeztünk ezen a képen, és egy igazi molekuláris orbitális számítás kissé eltérő eredményeket adhat., Ennek ellenére továbbra is három, valamint két nem kötődő elektronpár kötési sorrendjét tárná fel.
ezenkívül néha a molekuláris orbitális képeket különböző módon mutatják be. A molekuláris orbitális interakciós diagram azt mutatja, hogy az atomi vagy molekuláris pályák hogyan egyesülnek össze, hogy új pályákat hozzanak létre. Néha talán csak a molekuláris orbitális energiaszintek érdekelnek minket, és nem az, hogy honnan jöttek. A molekuláris orbitális energiaszint diagram csak a molekula energiaszintjét mutatja., Gyakran, de nem mindig, az energiaszint diagramokat a pályák képei nélkül mutatják be annak érdekében, hogy a figyelmet az energiaszintekre összpontosítsák, amelyek alapvetően a kép legfontosabb részét képezik. Továbbá, mivel csak a megszállt energiaszintek járulnak hozzá a molekula energiájához, néha a magasabb energiájú, üres pályák kimaradnak a képből.

nagyon gyakran a molekuláris orbitális számítások eredményei megerősítik azt, amit a Lewis-struktúrákból megjósolnánk., Ha a dinitrogén Lewis szerkezetét rajzolja meg, akkor egy hármas nitrogén-nitrogén kötést is meg fog jósolni. A molekuláris orbitális elmélet legfőbb előnye, hogy lehetővé teszi az energia kvantitatív előrejelzését, amikor valódi számítást végzünk egy számítógépen. Ezenkívül fontos felismerni, hogy az oktett-szabálynak nincs valódi oka, hacsak nem vesszük figyelembe a kvantummechanikát. A Lewis-struktúrák empirikus megfigyelésen alapulnak, hogy az elektronok párokat és oktetteket alkotnak anélkül, hogy megpróbálnák megmagyarázni, miért., A molekuláris orbitális elmélet Néhány alapvető összefüggést elvesz a fizikától, és nagyon bonyolult molekulákra alkalmazza őket, nagyon jó sikerrel. Csak azáltal, hogy ismerjük a molekulában lévő elektronok számát, és körülbelül tudjuk, hol helyezkednek el a magok a szerkezetben, a molekuláris orbitális számítások nagyon hasznos információkat adnak az energiáról. Ezen túlmenően az N2-nél bonyolultabb esetekben ezek a számítások még a molekuláris geometriával Kapcsolatos Első találgatásunkat is korrigálhatják, ahol a kötések találhatók.,
Exercise \ (\PageIndex{2}\)
egy diatomi molekula (két atom) molekuláris orbitális diagramja az elektronok számában változik. Hogyan lehet feltölteni az elektronokat?
válasz
* számolja meg a vegyértékű elektronokat a molekulán. Ez az egyes atomok valenciaelektronjainak száma, a molekula bármely töltéséhez igazítva. (pl. C22-10 valence elektronnal rendelkezik: 4 minden szénből — ez 8 — és még kettő a 2 töltéshez).
* először töltse be az elektronokat a legalacsonyabb energiájú pályákba.
* pár elektronok után minden pályák azonos energiaszinten van egy elektron.,
Exercise \(\PageIndex{3}\)
kvalitatív molekuláris orbitális diagram készítése klór, Cl2 esetén. Hasonlítsa össze a kötési sorrendet a Lewis-struktúrában látottakkal (ne feledje, hogy egy antibonding orbitális elektron megszakítja a stabilizációt egy elektron kötési orbitális kötése miatt).
válasz 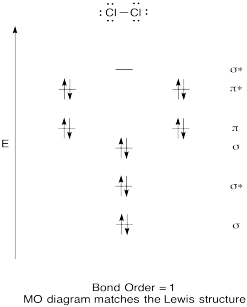
gyakorlat \(\PageIndex{4}\)
- minőségi molekuláris orbitális diagram létrehozása az oxigénhez, O2.
- hasonlítsa össze a kötési sorrendet a Lewis-struktúrában láthatóval.,
- hogyan hasonlítható össze ez az oxigén MO-képe a Lewis-struktúrával? Mit mond a két struktúra az elektronpárosításról?
- azok a vegyületek, amelyeknek minden elektronjuk párosul, diamágneses. Azok párosítatlan elektronok nevezik paramágneses. A paramágneses anyagokat mágneses mező vonzza, de a diamágneses dolgok nem. Hogyan várná el, hogy a molekuláris oxigén viselkedjen?,
válasz
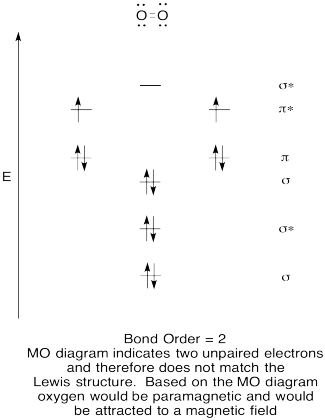
gyakorlat \(\PageIndex{5}\)
- készítsen minőségi molekuláris orbitális diagramot a peroxid anionhoz, O22-.
- hasonlítsa össze a kötési sorrendet a Lewis-struktúrában láthatóval.
- hogyan hasonlítható össze ez az oxigén MO-képe a Lewis-struktúrával? Mit mond a két struktúra az elektronpárosításról?,
- a molekuláris orbitális képek alapján Ön szerint mennyire lehet A dioxigént peroxidra redukálni (két elektron hozzáadásával)?
válasz
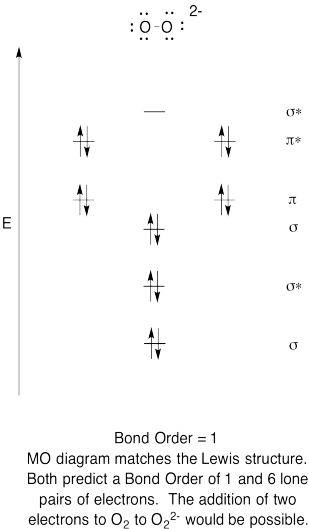
Exercise \(\PageIndex{6}\)
kvalitatív molekula orbitális orbitális pályája van, B2. Gondolod, hogy a bór-bór kötések e kép alapján könnyen kialakulhatnak?,
válasz
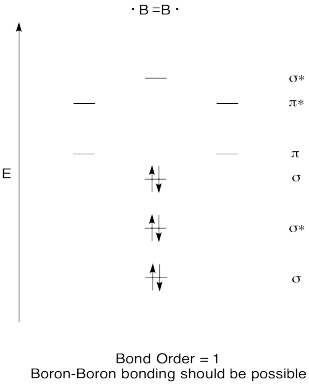
gyakorlat \(\PageIndex{7}\)
li > készítsen minőségi molekuláris orbitális diagramot a dicarbon, C2 számára.
válasz
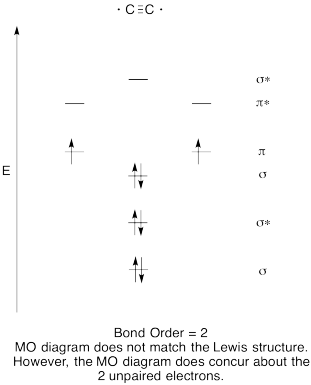
gyakorlat \(\PageIndex{8}\)
- kvalitatív molekuláris orbitális diagram létrehozása az acetilid anionhoz, C22-.
- hasonlítsa össze a kötési sorrendet a Lewis-struktúrában láthatóval.
- hogyan hasonlítható össze ez az oxigén MO-képe a Lewis-struktúrával? Mit mond a két struktúra az elektronpárosításról?,
- a molekuláris orbitális képek alapján Ön szerint milyen könnyen csökkenthető a dikarbon acetilidre (két elektron hozzáadásával)?
válasz
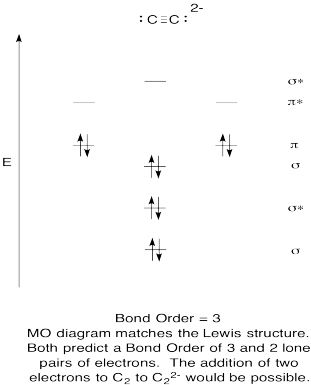
gyakorlat \(\PageIndex{9}\)
összefoglalja az orbitals populációjának hatását.
válasz
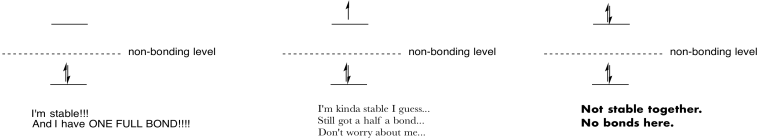
Attribution
Chris P Schaller, Ph. D.,, (Szent Benedek Kollégium / Szent János Egyetem)