l’étude de la cinétique permet aux scientifiques de déterminer la relation entre les changements de conditions et la vitesse d’une réaction chimique particulière. L’un des facteurs les plus importants qui affectent la vitesse d’une réaction est la réactivité des produits chimiques impliqués dans cette réaction spécifique; de plus, plusieurs variables peuvent également influer sur la vitesse d’une réaction (concentration, température, catalyseur, etc.).
l’Une de ces variables est considérée comme une collision.,
toute réaction chimique nécessite des collisions entre les particules réactives (atomes et / ou molécules). D’autre part, toutes les collisions ne favorisent pas la réaction. Au lieu de cela, si les particules en collision n’ont pas suffisamment d’énergie cinétique ou d’orientation appropriée dans l’espace, la réaction ne se produira pas.
mais qu’entend – on par « énergie suffisante” ou « orientation appropriée”? Pour avoir une meilleure idée des concepts mentionnés précédemment, l’article fournira quelques définitions générales accompagnées d’exemples correspondants et d’exemples de problèmes.,
Notre objectif principal est de définir la notion d’énergie d’activation et d’expliquer pourquoi certaines de ces collisions ne pas provoquer une réaction.
en conséquence, cet article se concentrera principalement sur le concept de collision réactive. Parallèlement à cela, nous allons brièvement passer en revue certains scénarios impliquant des collisions non réactives. Étant donné que les collisions sont associées à deux caractéristiques majeures, l’énergie et l’orientation spatiale, nous discuterons également de ces termes.,
théorie des collisions
Comme nous l’avons déjà mentionné ci-dessus, des collisions entre deux molécules ou plus doivent se produire pour qu’une réaction chimique ait lieu. Mais la collision ne suffit pas pour que les réactifs soient transformés en produits. Les molécules doivent avoir suffisamment d’énergie et entrer en collision avec l’orientation spatiale correcte.
comme vous le savez peut-être déjà, il existe différents types de réactions, y compris la synthèse, la décomposition, le déplacement et la combustion., Compte tenu du fait que la théorie des collisions se concentre sur les réactions impliquant des collisions entre deux espèces, vous n’avez pas à vous soucier des réactions de décomposition car, dans de tels cas, un seul composé est effondré et il n’est pas nécessaire de considérer les collisions ou l’orientation des particules dans l’espace.
dans le cas de réactions impliquant deux espèces, les collisions entre les molécules sont cruciales pour le déroulement de la réaction; mais, seules les collisions de molécules ayant une énergie cinétique suffisante et une orientation spatiale pertinente peuvent provoquer une réaction., Ainsi, l’énergie est nécessaire pour briser les liaisons dans les molécules réagissant, tandis que l’orientation des molécules dans l’espace joue un rôle important dans l’alignement des atomes appropriés les uns avec les autres pour réformer les liaisons rompues de la manière appropriée.
lorsque les deux critères sont satisfaits, la collision est considérée comme une collision réussie, efficace ou réactive.
compte tenu de l’importance des deux facteurs mentionnés ci-dessus (énergie et orientation), nous devrions poursuivre l’explication des Termes et des concepts pour mieux comprendre les principes de la théorie des collisions.,
énergie D’Activation
Comme nous l’avons déjà mentionné précédemment, les particules doivent entrer en collision avec suffisamment d’énergie pour qu’une réaction se produise. Cette énergie minimale requise pour que la réaction se poursuive est définie comme l’énergie d’activation.,
comme vous le savez peut – être, il existe deux types de réactions concernant la libération ou l’absorption d’énergie qui sont les suivantes:
- réaction endothermique – l’énergie est absorbée dans une réaction (généralement sous forme de chaleur)
- réaction exothermique-l’énergie est libérée dans une réaction (généralement sous forme de chaleur)
à première vue, il peut sembler que puisque l’énergie est libérée dans une réaction exothermique, il ne devrait pas être nécessaire d’entrer de l’énergie pour la réaction exothermique.réaction à se produire. Au contraire, les réactions chimiques endothermiques et exothermiques nécessitent de l’énergie pour commencer.,
cela semble un peu étrange, non? Pourquoi une réaction besoin de la contribution de l’énergie si l’énergie est donc sorti?
considérons les exemples suivants de réactions exothermiques survenant dans notre vie quotidienne.

Exemple #1 – la Combustion d’une Bougie
La combustion d’une bougie libère de l’énergie sous forme de chaleur; par conséquent, la réaction se produisant au cours du processus exothermique. Évidemment, vous devez allumer la bougie à l’aide d’une allumette ou d’un briquet., Cela signifie que vous devez entrer de l’énergie pour que la bougie s’allume. Après cela, la réaction a suffisamment d’énergie pour passer aux étapes suivantes, et la bougie continue à brûler de l’énergie.
cependant, une bougie ne s’enflammera jamais toute seule, n’est-ce pas?
Exemple #2 – allumer une Allumette

Un match typique de tête est composé de soufre mélangé avec différents agents oxydants. Pour allumer l’allumette, vous devez frotter la tête d’allumette contre le côté spécial d’une boîte d’allumettes., Au cours de ce processus, une réaction a lieu et libère de l’énergie sous forme de lumière et de chaleur. Ainsi, la réaction est considérée comme exothermique. Bien que, vous devez toujours entrer un peu d’énergie pour que l’allumette commence à brûler. Cette énergie est définie par le terme « énergie d’activation. »Comme dans l’exemple précédent, tant que vous fournissez suffisamment d’énergie pour que l’allumette s’allume, elle continuera à brûler et à libérer de la chaleur par elle-même.
le graphique D’énergie D’Activation représente les changements d’énergie qui se produisent au cours d’une réaction chimique.,
pour tracer le graphique de l’énergie d’activation, il est crucial de considérer deux variables:
- Nombre de collisions entre différentes molécules
- énergie cinétique des molécules en collision
la première variable est assez facile à comprendre car elle a un sens direct – elle définit le nombre de collisions entre les particules de deux espèces par seconde.
La deuxième variable est l’énergie cinétique de la collision des molécules, qui peut être définie comme l’énergie de mouvement des molécules.
- réaction endothermique – l’énergie est absorbée., L’énergie des réactifs est inférieure à l’énergie des produits.
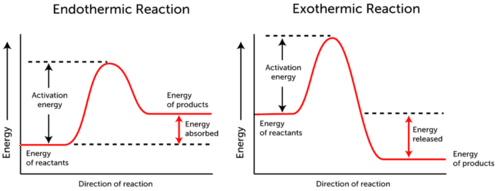
- Exothermique de la Réaction de l’énergie est libérée. L’énergie des réactifs est plus que l’énergie de produits.
comme vous pouvez le voir dans les deux Graphiques ci-dessus, l’énergie d’activation pour les réactions endothermiques et exothermiques est la même.,
étant donné que la réaction endothermique ne peut pas produire autant d’énergie qu’elle doit consommer pour que la réaction se produise, l’énergie est absorbée; par conséquent, l’énergie des produits est supérieure à l’énergie des réactifs.
au contraire, les réactions exothermiques produire plus d’énergie qu’ils utilisent comme énergie d’activation. En conséquence, l’énergie est libérée et les produits ont une énergie inférieure à celle des réactifs.,
En conclusion, on peut affirmer que même si les molécules réactives entrent rapidement en collision les unes avec les autres, il est essentiel que les molécules aient suffisamment d’énergie pour que la réaction se produise.
orientation spatiale
selon la théorie des collisions, toutes les collisions ne sont pas réussies, même si les molécules réactives ont une énergie d’activation suffisante. Les molécules doivent également entrer en collision dans le bon sens.
ainsi, le deuxième aspect qui influence les collisions réactives est considéré comme l’orientation spatiale (orientation des molécules dans l’espace).,
qu’entend – on par” bonne » orientation des molécules dans une réaction?
lorsque deux molécules entrent en collision, les deux molécules doivent être situées de manière à ce qu’il soit facile pour elles de réagir. Pour bien comprendre le concept, il est important de mettre en évidence le mécanisme de la réaction.
considérons la réaction entre le propylène (ou propène) et de bromure d’hydrogène comme un exemple:

Comme vous pouvez le voir ci-dessus, la réaction se déroule en 2 étapes.,
Étape 1: la double liaison est rompue
Étape 2: le brome est attaché
dans cette réaction, les orientations moléculaires de HBr et de C3H6 jouent un rôle important puisque l’un d’entre eux étant situé d’une autre manière, il n’aurait pas été possible pour L’atome H de s’approcher de la molécule de propylène.
C’est vrai pour chaque réaction. Chaque molécule doit avoir la bonne orientation dans l’espace pour que la réaction ait lieu. Une orientation correcte garantit que les molécules sont situées de manière à ce qu’il soit relativement facile pour elles de se heurter et de réagir.,
Nous pouvons conclure que l’orientation favorable des molécules réactives est aussi essentielle qu’une énergie d’activation suffisante.
résumé
les Termes et concepts définis tout au long de l’article sont résumés dans le tableau ci-dessous:
| la théorie des collisions | explique comment les particules l’autre pour provoquer une réaction., Selon la théorie des collisions, deux critères doivent être remplis pour qu’une réaction chimique ait lieu: les molécules doivent entrer en collision avec une énergie d’activation suffisante pour rompre et reformer les liaisons existantes; les molécules doivent entrer en collision avec une orientation spatiale favorable. |
| Collision réussie (également appelée collision efficace ou réactive) | collision de molécules ayant une énergie d’activation suffisante et une orientation appropriée dans l’espace qui entraîne une réaction chimique., |
| Énergie d’Activation | Le minimum d’énergie nécessaire à la réaction de se produire. L’apport d’énergie est nécessaire en cas de réactions endothermiques et exothermiques. |
| réaction endothermique | L’énergie (chaleur) est absorbée; l’énergie des réactifs est inférieure à l’énergie des produits; ne peut pas produire autant d’énergie qu’elle consomme pendant la réaction., |
| réaction exothermique | L’énergie (chaleur) est libérée; l’énergie des réactifs est supérieure à l’énergie des produits; peut produire plus d’énergie qu’elle n’en consomme pendant la réaction. |
| Orientation Moléculaire | l’orientation Spatiale des molécules., |
Three different scenarios are represented in the picture attached below:
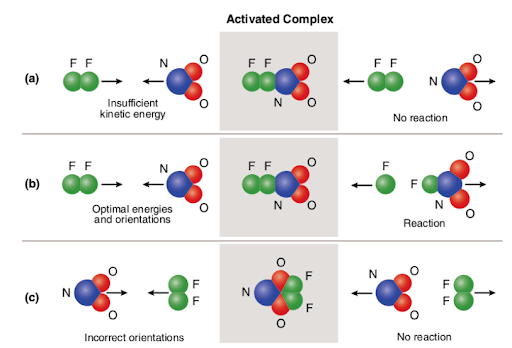
The picture summarizes the concept of collision theory utilizing two reactant molecules (fluorine (F2) and molecular nitrogen dioxide (NO2)) and three different cases to form nitrogen oxyfluoride.,
dans le cas de (a), Les molécules réactives ont une orientation spatiale appropriée mais n’ont pas une énergie d’activation suffisante; par conséquent, la réaction ne se produit pas du fait qu’il n’y a pas assez d’énergie pour rompre les liaisons. Ainsi, la collision entre les deux molécules est considérée comme non réactive.
dans le cas de (b), les molécules réactives ont à la fois une énergie d’activation suffisante et une orientation appropriée dans l’espace. En raison des caractéristiques optimales des molécules, la réaction se déroule et l’oxyfluorure d’azote est formé., Ainsi, la collision entre les deux molécules est considérée comme réactive.
dans le cas de (c), Les molécules réactives ont une énergie d’activation suffisante mais ne sont pas correctement situées dans l’espace; par conséquent, la réaction n’a pas lieu car il n’est pas possible pour les molécules d’atteindre l’une l’autre de la manière qui rompt les liaisons. Ainsi, de même que dans le premier cas, la collision entre les deux molécules est considérée comme non réactive.