Richard Baxter et Jim Britton
comment l’acier se corrode-t-il dans l’eau?
Pour comprendre la protection cathodique, vous devez d’abord comprendre comment la corrosion est due. Pour que la corrosion se produise, trois éléments doivent être présents:
1. Deux métaux différents
2. Un électrolyte(eau contenant tout type de sel ou de sels dissous)
3., Un chemin métallique (conducteur) entre les métaux dissemblables
Les deux métaux dissemblables peuvent être des alliages totalement différents – tels que l’acier et l’aluminium – mais sont plus susceptibles d’être des différences métallurgiques microscopiques ou macroscopiques à la surface d’une seule pièce d’acier. Dans ce cas, nous considérerons l’acier corrosif librement, qui n’est pas uniforme.
Si les conditions ci-dessus existent, la réaction suivante a lieu aux sites les plus actifs: (deux ions fer plus quatre électrons libres).,
2Fe =>2Fe++ + 4e-
Les électrons libres traversent le chemin métallique vers les sites moins actifs, où la réaction suivante a lieu: (l’oxygène gazeux est converti en ion oxygène – en se combinant avec les quatre électrons libres – qui se combine avec l’eau pour former des ions hydroxyles).
O2 + 4e- + 2h20 => 4 OH-
la recombinaison de ces ions à la surface active produit la réaction suivante, qui donne le produit de corrosion du fer hydroxyde ferreux: (fer combinant avec l’oxygène et l’eau pour former de l’hydroxyde ferreux).,
2FE + O2 + 2H2O =>2FE (OH)2
Cette réaction est plus communément décrite comme » le courant traverse l’eau de l’anode (site plus actif) à la cathode (site moins actif).’
comment la protection cathodique arrête-t-elle la corrosion?
La Protection cathodique empêche la corrosion en convertissant tous les sites anodiques (actifs) de la surface métallique en sites cathodiques (passifs) en fournissant du courant électrique (ou des électrons libres) à partir d’une source alternative.
Habituellement, cela prend la forme d’anodes galvaniques, qui sont plus actifs que l’acier., Cette pratique est également appelée système sacrificiel, car les anodes galvaniques se sacrifient pour protéger l’acier de construction ou le pipeline de la corrosion.
dans le cas des anodes en aluminium, la réaction à la surface de l’aluminium est: (quatre ions aluminium plus douze électrons libres)
4Al => 4AL+++ + 12 e –
et à la surface de l’acier: (oxygène gazeux converti en ions oxygène qui se combinent avec l’eau pour former des ions hydroxyle).,
3O2 + 12e- + 6h20 =>12OH-
tant que le courant (électrons libres) arrive à la cathode (acier) plus rapidement que l’oxygène arrive, aucune corrosion ne se produira.,
considérations de base lors de la conception de systèmes d’anodes sacrificielles
Le courant électrique qu’une anode décharge est contrôlé par la loi D’Ohm, qui est:
I=E/R
i= flux de courant en ampères
E= différence de potentiel entre l’anode et la cathode en volts
R= résistance totale et la cathode sont élevées, mais à mesure que la différence de potentiel diminue en raison de l’effet du flux de courant sur la cathode, le courant diminue progressivement en raison de la polarisation de la cathode., La résistance du circuit comprend à la fois le chemin d’eau et le chemin métallique, qui comprend n’importe quel câble dans le circuit. La valeur dominante ici est la résistance de l’anode de l’eau de mer.
pour la plupart des applications, la résistance du métal est si faible par rapport à la résistance à l’eau qu’elle peut être ignorée (bien que cela ne soit pas vrai pour les traîneaux ou les longs pipelines protégés des deux extrémités). En général, les anodes longues et minces ont une résistance plus faible que les anodes courtes et grasses. Ils déchargeront plus de courant mais ne dureront pas aussi longtemps.,
Par conséquent, un concepteur de protection cathodique doit dimensionner les anodes de sorte qu’elles aient la bonne forme et la bonne surface pour décharger suffisamment de courant pour protéger la structure et suffisamment de poids pour durer la durée de vie souhaitée lors de la décharge de ce courant.
en règle générale de pouce:
La durée de l’anode détermine la quantité de courant à l’anode peut produire, et par conséquent, combien de pieds carrés d’acier peuvent être protégés. La section transversale (poids) détermine combien de temps l’anode peut supporter ce niveau de protection.,
systèmes de protection cathodique à courant impressionné (systèmes D’anodes ICCP)
en raison des courants élevés impliqués dans de nombreux systèmes d’eau de mer, il n’est pas rare d’utiliser des systèmes à courant impressionné qui utilisent des anodes d’un type (anodes ICCP) qui ne sont pas facilement dissous en ions métalliques. Cela provoque une réaction alternative: l’oxydation des ions chlorure dissous.
2 cl- => Cl2 + 2e-
l’Alimentation est fournie par une alimentation CC externe de l’unité.,

Comment savons-nous quand nous avons suffisamment de protection cathodique?
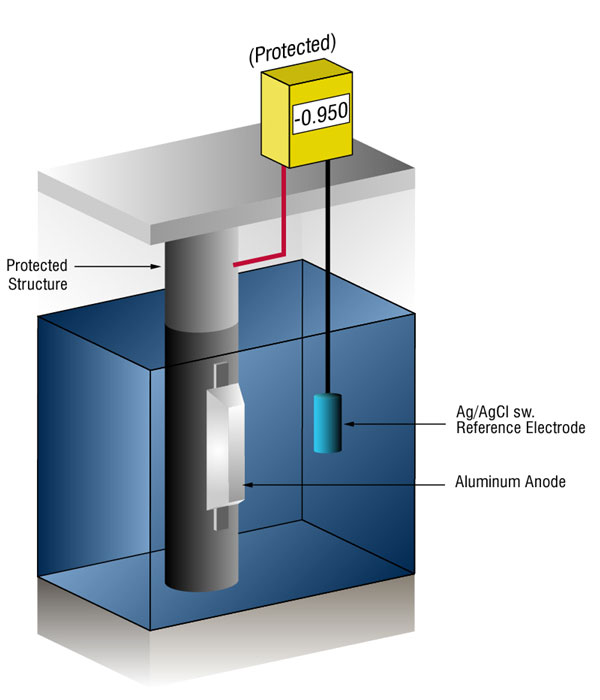
Nous pouvons vérifier qu’il y a suffisamment de courant en mesurant le potentiel de l’acier par rapport à une électrode de référence standard, généralement de l’argent/chlorure d’argent (Ag/AgCl sw.), mais parfois du zinc (sw.).
le flux de courant sur n’importe quel métal déplacera son potentiel normal dans la direction négative. L’histoire a montré que si l’acier reçoit suffisamment de courant pour déplacer le potentiel à ( – ) 0.800 V vs., silver / silver chloride (Ag / AgCl), the corrosion is essentially stopped.
 |
 |