catégorie: Chimie
publié: 9 décembre 2013
Oui, l’eau peut rester liquide en dessous de zéro degré Celsius. Il existe quelques façons dont cela peut se produire.
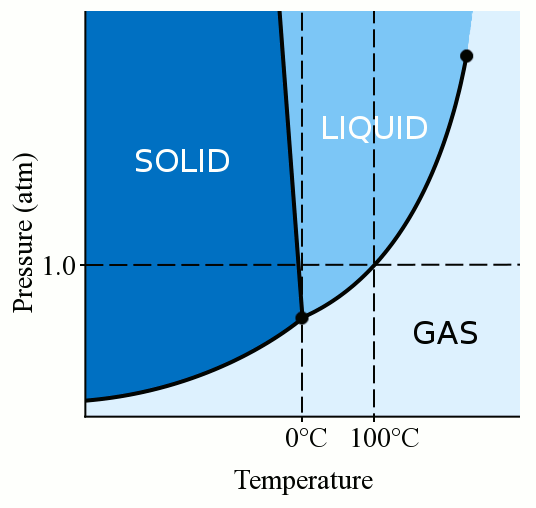
tout d’abord, la phase d’un matériau (qu’il soit gazeux, liquide ou solide) dépend fortement de sa température et de sa pression., Pour la plupart des liquides, l’application de pression augmente la température à laquelle le liquide gèle en solide. Un solide se forme lorsque les molécules lâches et sinueuses d’un liquide deviennent assez lentes et assez proches pour former des liaisons stables qui les fixent en place. Lorsque nous appliquons une pression sur un liquide, nous forçons les molécules à se rapprocher. Ils peuvent donc former des liaisons stables et devenir un solide même s’ils ont une température plus élevée que le point de congélation à pression standard. L’eau est quelque peu unique, cependant. Les molécules d’eau s’étalent lorsqu’elles se lient dans une structure cristalline solide., Cette action d’étalement conduit la glace à être moins dense que l’eau liquide, ce qui fait flotter la glace. Cette action d’étalement des molécules d’eau pendant la congélation signifie également que l’application de pression sur l’eau abaisse le point de congélation. Si vous appliquez une pression suffisante (ce qui rend difficile la propagation des molécules d’eau dans la structure solide), vous pouvez avoir de l’eau liquide plusieurs degrés en dessous de zéro degré Celsius.
même si vous n’appliquez pas de pression, vous pouvez toujours avoir de l’eau liquide à des températures inférieures à zéro en utilisant des additifs., Les additifs tels que le sel peuvent interférer avec la liaison chimique nécessaire pour former un solide et ils peuvent donc abaisser le point de congélation de l’eau. Le sel est composé d’ions sodium et chlore forts. Lorsqu’elles sont dissoutes dans l’eau, les molécules d’eau ont tendance à coller aux ions de sel au lieu de les uns aux autres, et elles ne gèlent donc pas aussi facilement. Lorsque vous ajoutez plus de sel à l’eau, son point de congélation continue de baisser jusqu’à ce que l’eau atteigne la saturation et ne puisse plus contenir de sel. Si vous ajoutez suffisamment de sel, le point de congélation de l’eau peut tomber aussi bas que -21 degrés Celsius., Ce fait signifie que l’eau à -21 degrés Celsius peut encore rester liquide si suffisamment de sel est ajouté. Au lieu d’empêcher l’eau liquide de geler, cette puissante propriété du sel peut également être utilisée pour transformer la glace en eau. Saupoudrer de sel sur les trottoirs glacés abaisse le point de congélation de la glace en dessous de la température ambiante et la glace fond. Mais saupoudrer de sel sur les allées glacées n’aidera pas si la température ambiante est inférieure à -21 degrés Celsius. L’effet du sel sur le point de congélation de l’eau a également des effets profonds sur les océans de la terre.,
même si vous n’appliquez pas de pression et n’ajoutez rien à l’eau, vous pouvez toujours avoir de l’eau liquide à des températures inférieures à zéro degré Celsius. Pour que l’eau gèle en glace, elle a besoin de quelque chose à geler pour démarrer le processus. Nous appelons ces points de départ « centres de nucléation ». Dans la plupart des situations, un peu de poussière, d’impureté ou même de petites vibrations dans l’eau fournissent des centres de nucléation sur lesquels l’eau peut geler. Mais si votre eau est très pure et très calme, il n’y a rien pour que les molécules d’eau cristallisent sur., En conséquence, vous pouvez refroidir l’eau très pure bien en dessous de zéro degré Celsius sans qu’elle gèle. L’eau dans cet état est appelée « surfusion ». À la pression standard, l’eau pure peut être surfondue jusqu’à environ -40 degrés Celsius. L’eau surfondue ne gèle que par l’absence de centres de nucléation. Par conséquent, une fois que les centres de nucléation sont fournis (ce qui pourrait être aussi simple qu’une vibration), l’eau surfondue gèle rapidement. La pluie verglaçante est un exemple naturel d’eau liquide surfondue., Une fois que la pluie verglaçante frappe un objet à la surface de la terre, cet objet fournit des centres de nucléation, et la pluie gèle en glace.
sujets: GEL, point de congélation, pluie verglaçante, glace, diagramme de phase, pression, surfusion, température, Eau