objectifs d’apprentissage
- pour mieux comprendre la théorie des collisions.
- pour comprendre les quatre principaux facteurs qui affectent la vitesse de réaction.
la cinétique de réaction est l’étude de la vitesse des réactions chimiques, et les vitesses de réaction peuvent varier considérablement sur une large gamme d’échelles de temps. Certaines réactions peuvent se produire à des vitesses explosivement rapides comme la détonation de feux d’artifice (Figure 17.,1 « Feux d’artifice la nuit au-dessus de la rivière »), tandis que d’autres peuvent se produire à un rythme lent sur de nombreuses années comme la rouille des barbelés exposés aux éléments (Figure 17.2”fil de fer barbelé rouillé »).
Figure 17.1. Feux D’artifice la nuit au-dessus de la rivière

la réaction chimique dans les feux d’artifice se produit à une vitesse explosive.
Figure 17.2. Fil de fer Barbelé rouillé

La rouille de fer barbelé se produit sur de nombreuses années.,
théorie des collisions
pour comprendre la cinétique des réactions chimiques et les facteurs qui affectent la cinétique, nous devrions d’abord examiner ce qui se passe lors d’une réaction au niveau moléculaire. Selon la théorie de la réactivité par collision ,les réactions se produisent lorsque les molécules réactives » entrent en collision efficacement.” Pour qu’une » collision effective « se produise, les molécules réactives doivent être correctement orientées dans l’espace pour faciliter la rupture et la formation de liaisons et le réarrangement des atomes qui entraînent la formation de molécules de produits (Figure 17.3″visualisations de Collision »).
Figure 17.3., Visualisations de Collision
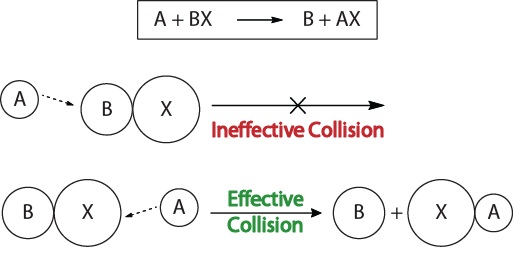
Cette visualisation montre une collision inefficace et efficace basée sur l’orientation moléculaire.
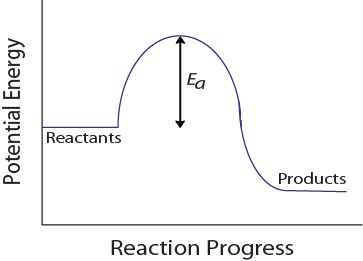
lors d’une collision moléculaire, les molécules doivent également posséder une quantité minimale d’énergie cinétique pour qu’une collision efficace se produise. Cette énergie varie pour chaque réaction et est connue sous le nom d’énergie d’activation (EA) (Figure 17.4 « énergie potentielle et Énergie D’Activation »)., La vitesse de réaction dépend donc de l’énergie d’activation; une énergie d’activation plus élevée signifie que moins de molécules auront suffisamment d’énergie pour subir une collision efficace.
Figure 17.4. L’Énergie potentielle et de l’Énergie d’Activation
facteurs qui affectent la vitesse
Il y a quatre facteurs principaux qui peuvent affecter la vitesse de réaction d’une réaction chimique:
1. Concentration du réactif., L’augmentation de la concentration d’un ou plusieurs réactifs augmentera souvent la vitesse de réaction. Cela se produit parce qu’une concentration plus élevée d’un réactif entraînera plus de collisions de ce réactif dans une période de temps spécifique.
2. État physique des réactifs et de la surface. Si des molécules réactives existent en différentes phases, comme dans un mélange hétérogène, la vitesse de réaction sera limitée par la surface des phases en contact., Par exemple, si un réactif métallique solide et un réactif gazeux sont mélangés, seules les molécules présentes à la surface du métal peuvent entrer en collision avec les molécules gazeuses. Par conséquent, augmenter la surface du métal en le martelant à plat ou en le coupant en plusieurs morceaux augmentera sa vitesse de réaction.
3. Température. Une augmentation de la température augmente généralement la vitesse de réaction. Une augmentation de la température augmentera l’énergie cinétique moyenne des molécules réactives., Par conséquent, une plus grande proportion de molécules aura l’énergie minimale nécessaire pour une collision efficace (Figure. 17.5 « température et vitesse de réaction »).
la Figure. 17.5 la Température et de la vitesse de Réaction
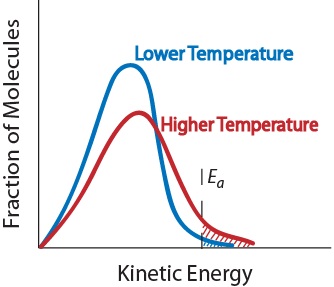
4. Présence d’un catalyseur. Un catalyseur est une substance qui accélère une réaction en y participant sans être consommée. Les catalyseurs fournissent une voie de réaction alternative pour obtenir des produits., Ils sont essentiels à de nombreuses réactions biochimiques. Ils seront examinés plus en détail dans la section « catalyse.”
principaux points à retenir
- Les réactions se produisent lorsque deux molécules réactives entrent en collision efficacement, chacune ayant une énergie minimale et une orientation correcte.
- la concentration du réactif, l’état physique des réactifs, la surface, la température et la présence d’un catalyseur sont les quatre principaux facteurs qui affectent la vitesse de réaction.