Introduction
cependant, plusieurs études animales ont montré que le CBD produit des courbes dose-réponse en forme de U inversé. Ces courbes ont été décrites pour la première fois chez des rats testés dans le modèle d’anxiété elevated plus maze (EPM) (Guimarães et al., 1990). Dans cette étude, le CBD a augmenté l’exploration à bras ouvert (un effet anxiolytique) à des doses de 2,5 à 10 mg/kg, mais pas à 20 mg / Kg (Guimarães et al., 1990)., Des courbes dose-réponse similaires en forme de cloche ont été décrites dans d’autres études portant sur les effets comportementaux du CBD. Par exemple, le poisson zèbre traité avec 0,5 mg/kg de CBD a passé beaucoup plus de temps dans la zone supérieure de l’aquarium (ce qui est interprété comme un effet anxiolytique), tandis que le comportement des poissons traités avec les doses les plus faibles (0,1 mg/kg) et les plus élevées (5 et 10 mg/kg) ne différait, 2015). Un schéma similaire a également été observé chez les rats spontanément hypertendus (SHRs), qui présentent un phénotype comportemental semblable à la schizophrénie., L’inhibition de prépulse dans cette souche de rats a été inversée par 30 mg / kg de CBD, mais pas par les doses de 15 et 60 mg/kg (Levin et al., 2014). La même chose a été observée en utilisant le modèle de déficience cognitive induite par la réserpine chez le rat, un modèle animal de la maladie de Parkinson et de la dyskinésie tardive. Alors que le CBD, à la dose de 0,5 mg/kg, atténuait le déficit de mémoire induit par la réserpine dans la tâche discriminative, la dose de 5 mg / kg s’est avérée inefficace (Peres et al., 2016).,
Il est clairement nécessaire d’explorer de nouvelles façons de gérer les troubles anxieux, car leur traitement reste problématique et implique généralement une combinaison de médicaments, y compris les benzodiazépines et les antidépresseurs. Ces médicaments ont leurs inconvénients tels que le risque de dépendance et le syndrome de sevrage, les effets secondaires sexuels, les troubles cognitifs et psychomoteurs, le début retardé de l’action (antidépresseurs), une faible acceptation et l’exigence d’un contrôle minutieux de la posologie (Katzman et al., 2014; Bandelow et coll., 2015; Sgnaolin et coll., 2016)., Le CBD ne semble pas induire d’effets indésirables significatifs chez l’homme (Bergamaschi et al., 2011b). Cependant, d’un point de vue thérapeutique possible, il est essentiel de déterminer si un schéma dose-réponse similaire en forme de U inversé est également présent chez l’homme. Afin d’étudier cette possibilité, nous avons choisi l’un des effets les plus cohérents du CBD, la diminution aiguë de l’anxiété. Cet effet a été décrit dans plusieurs modèles animaux et chez des volontaires sains et des patients atteints de trouble d’anxiété sociale (Sad) (Guimarães et al., 1990; Zuardi et coll., 1993; Bergamaschi et coll., 2011a; Crippa et coll.,, 2011); cependant, il n’a pas été étudié en utilisant des doses multiples chez l’homme.
Une méthode largement utilisée pour induire l’anxiété expérimentale chez l’homme est la tâche de parole en public simulée (SPST – Graeff et al., 2003). Le SPST est très cohérent dans l’élévation de l’anxiété auto-évaluée. Cependant, ses effets sur les réponses physiologiques (fréquence cardiaque, pression artérielle et sécrétion de cortisol) sont moins cohérents (Palma et al., 1994; Hetem et coll., 1996; de-Paris et coll., 2003)., Une méta-analyse de 11 études utilisant le SPST a confirmé cette observation, montrant une augmentation significative de la taille de l’effet global sur l’anxiété subjective, mais pas sur la pression artérielle systolique (SBP) et la fréquence cardiaque (Zuardi et al., 2013). Des preuves clairsemées dans la littérature suggèrent que parler en public dans une situation réelle est plus efficace pour augmenter les réponses physiologiques (Turner et al., 1990; Dickerson et Kemeny, 2004). Dans une étude récente, nous avons comparé le test de prise de parole en public en situation réelle (TPSRS) et le SPST., Les résultats ont montré que les deux méthodes étaient efficaces pour augmenter l’anxiété subjective, mais seul le TPSRS a augmenté la fréquence cardiaque, la SBP et la pression artérielle diastolique (DBP) (Zuardi et al., 2013).
la présente étude a donc été conçue pour tester l’hypothèse selon laquelle l’augmentation des doses de CBD produirait des effets anxiolytiques dans un schéma dose-réponse en forme de U inversé chez des volontaires sains soumis au TPSRS.,
matériaux et méthodes
sujets
soixante hommes et femmes en bonne santé âgés de 18 à 35 ans, sans antécédents de maladie psychiatrique passée ou actuelle, de dépendance à l’alcool ou à d’autres drogues ont été recrutés par publicité sur le campus de L’Université de São Paulo à Ribeirão Preto. Les Participants ayant des problèmes de santé majeurs ou qui prenaient des médicaments susceptibles d’interférer avec les résultats de l’étude n’ont pas été inclus., Les volontaires ont été interviewés afin d’évaluer leur admissibilité et de mesurer leur propension à l’anxiété grâce à la version trait de L’inventaire de L’anxiété État-Trait de Spielberger (STAI – Spielberger et al., 1970). Les participants admissibles qui ont accepté de participer ont reçu l’ordre de s’abstenir de drogues dans la semaine précédant les tests et d’alcool et de caféine dans les 24 heures précédant le test., Tous les volontaires ont donné leur consentement écrit et éclairé pour participer après avoir été pleinement informés des procédures de recherche, qui étaient conformes aux termes actuels de la déclaration d’Helsinki et ont été approuvés par le Comité D’éthique de L’Hôpital Universitaire de la Faculté de Médecine de Ribeirão Preto (HCRP-No.12407/09).
Les volontaires ont été répartis au hasard dans cinq groupes de 12 sujets chacun pour recevoir différentes doses de CBD (100, 300 et 900 mg), de clonazépam (1 mg) ou de placebo dans un plan randomisé en double aveugle., Les groupes ont été appariés selon le sexe, l’âge, l’indice de masse corporelle (IMC) et le score du trait STAI. Un volontaire du groupe CBD – 300 n’a pas pu assister à la session expérimentale en raison de problèmes personnels et a été retiré de l’étude.
médicaments
La poudre de Cannabidiol avec une pureté de 99,6% (aucun autre cannabinoïde présent) dissoute dans l’huile de maïs à des doses de 100 et 200 mg / ml a été gentiment fournie par Biosynthesis Pharma Group (Bspg-Pharm, Sandwich, UK). La solution de CBD, les comprimés de clonazépam (Rivotril®, Roche Lab) et le placebo (huile de maïs) ont été emballés dans des capsules de gélatine identiques., Tous les volontaires ont reçu cinq capsules d’un millilitre chacune, dans les combinaisons suivantes: cinq capsules contenant de l’huile de maïs (groupe placebo); une capsule de CBD 100 mg/ml et quatre capsules d’huile de maïs (groupe CBD-100); trois capsules de CBD 100 mg/ml et deux capsules d’huile de maïs (groupe CBD-300); quatre capsules de CBD 200 mg/ml et une capsule de CBD 100 mg/ml (groupe CBD-900); et une capsule contenant du clonazépam et quatre capsules d’huile de maïs (groupe de clonazépam – clon)., Chaque traitement a reçu un nombre aléatoire et tant l’investigateur en charge de la distribution des gélules que le volontaire n’étaient pas au courant de leur contenu (double aveugle). Enfin, le choix de l’intervalle entre l’administration du médicament et le TPSRS a été basé sur des études pharmacologiques antérieures montrant que les concentrations plasmatiques maximales de CBD et de CLON prises par voie orale se produisent généralement entre 2 et 3 h après l’ingestion (Agrell et al., 1981; Crevoisier et coll., 2003; Borgwardt et coll., 2008; Fusar-Poli et coll., 2009; Martin-Santos et coll., 2012)., Le CBD subit un effet de premier passage significatif conduisant à la formation d’un certain nombre de métabolites et sa demi-vie chez l’homme s’est avérée comprise entre 2 et 5 jours après l’administration orale. La biodisponibilité du CBD oral chez l’homme est d’environ 6%, ce qui confirme l’idée qu’il a un effet de premier passage substantiel (Zhornitsky et Potvin, 2012). Les taux plasmatiques moyens de CBD à 1, 2 et 3 h après l’administration aiguë de 600 mg étaient respectivement de 0,36, 1,62 et 3,4 ng/ml (Martin-Santos et al., 2012)., Le choix des doses utilisées dans cette étude était basé sur des preuves antérieures montrant que l’administration orale aiguë de 300 mg de CBD avait des effets anxiolytiques dans le SPST (Zuardi et al., 1993).
mesures psychologiques
deux facteurs de la Visual Analog Mood Scale (VAMS), traduits et validés en portugais par Zuardi et Karniol (1981), ont été utilisés pour évaluer les niveaux d’anxiété et les effets sédatifs pendant le test. Le VAMS est un instrument auto-administré composé de 16 éléments. Avant le Repp, chaque bénévole a suivi une séance de formation pour compléter l’échelle., On a demandé aux sujets de marquer le point qui identifiait leur état subjectif actuel sur une ligne droite de 100 mm placée entre deux mots qui décrivent des États d’Humeur opposés (p. ex., détendu-tendu). Une analyse factorielle de la version portugaise de l’échelle identifié quatre facteurs (Zuardi et coll.,, 1993): (1) « anxiété », comprenant les éléments calme–excité, détendu–tendu et tranquille–troublé; (2) « sédation », y compris les éléments alerte–somnolent et attentif–rêveur; (3) « déficience cognitive », y compris vif d’esprit-mentalement lent, compétent–incompétent, énergique–léthargique, lucide–muzzy, grégaire-retiré, bien coordonné–maladroit et fort–faible; et (4) « inconfort », y compris les éléments intéressés-ennuyé, heureux–triste, content–mécontent, et amical–antagoniste (parente et al., 2005). Depuis des études antérieures avec les deux anxiogènes (Crippa et al., 2004; Parente et coll.,, 2005) et des médicaments anxiolytiques, y compris le CBD (Crippa et al., 2004, 2011; Bergamaschi et coll., 2011a) ont montré que seuls les facteurs d’anxiété et de sédation présentent des changements lors des tâches de prise de parole en public, nous n’avons utilisé que les éléments de ces facteurs du VAMS pour réduire le temps d’administration et permettre l’exécution du protocole. Cette procédure a déjà été utilisée dans l’étude de validation du PSRST (Zuardi et al., 2013).
mesures physiologiques
la pression artérielle systolique, le DBP et la fréquence cardiaque (HR) ont été mesurés avec un sphygmomanomètre numérique (Omron, Brésil).,
Test de prise de parole en public en Situation réelle (TPSRS)
dans cette procédure, chaque sujet doit s’exprimer devant un groupe et, dans la même séance expérimentale, participer à l’audience lorsque les autres membres du groupe prennent la parole. Le public est invité à rester silencieux et à s’exprimer de manière neutre pendant les discours.
cinq séances expérimentales ont été réalisées avec 12 sujets chacune (sauf 1, qui comprenait 11 sujets). Au début de la session, les volontaires ont été informés du nombre de traitements qu’ils recevraient (comme détaillé ci-dessus)., Les volontaires ont ensuite été invités à prendre des sièges Marqués de leur numéro de traitement respectif. Les sièges étaient numérotés de telle sorte qu’à la fin des cinq séances, les sujets de chaque groupe de traitement avaient occupé toutes les positions possibles. La séquence des procédures suivait toujours le même ordre du premier au douzième président dans le but de minimiser un éventuel effet d’ordre dans la séquence des orateurs., Par exemple, les sujets de la CDB-300 groupe occupé les postes suivants: première session – 3, 8; deuxième session – 4, 9; troisième session – 5, 10; quatrième session – 1, 6, 11; cinquième session – 2, 7, 12.
procédure
Les volontaires ont commencé la séance expérimentale après un minimum de 6 h de sommeil et 2 h après avoir mangé un petit déjeuner standard (200 ml de lait au chocolat et 100 g de pain avec de la margarine).,
Les 12 volontaires se sont assis sur des chaises disposées en demi-cercle, suivant un ordre prédéterminé par le numéro de traitement attribué à chacun d’eux et ont effectué les mesures de base, suivies de la prise des cinq capsules dans un intervalle de 5 minutes pour chaque volontaire. Cette phase s’est achevée sur une période de 1 h. Les volontaires ont ensuite regardé un film sur les oiseaux de la forêt amazonienne d’une durée d’environ 20 min. Après cela, les mesures ont été répétées avec un intervalle de 5 min pour chaque sujet (mesure de pré-test)., 2 h et 20 min après que le premier volontaire ait reçu le traitement, ils ont tous regardé une vidéo d’environ 10 min avec des instructions enregistrées pour le test de la parole. 2 h et 30 min après que le premier volontaire a reçu le traitement, ils ont commencé à effectuer le test de la parole, qui a duré 5 min. Par la suite, les autres volontaires ont été soumis au test de la parole dans le même ordre dans lequel ils avaient reçu les traitements., Le test de parole consistait à préparer silencieusement un discours de 1 min sur un thème lié aux « conditions d’un service public de votre ville”, choisi par hasard parmi 12 options et révélé immédiatement avant la préparation du discours. Le discours préparé a ensuite été présenté pendant 2 min, avec les autres participants et les enquêteurs servant d’audience. Le discours a été interrompu à mi-chemin pour les mesures., La séquence des procédures dans cette phase était la suivante: (a) s’asseoir sur une chaise disposée devant les autres; (b) choisir le thème du discours; (c) réfléchir au thème pendant 1 min; (d) commencer le discours, qui a été interrompu après 1 min; (e) terminer l’échelle d’auto-évaluation (facteurs D’anxiété et de sédation VAMS) et les mesures physiologiques; (f) poursuivre le discours pendant une minute. Cette séquence a duré 5 min au maximum, de sorte qu’après 1 h, tous les volontaires avaient suivi la procédure. La phase finale de l’étude a commencé 216 min après que le premier volontaire ait pris le médicament., Toutes les mesures ont été répétées, en gardant l’intervalle de 5 minutes pour chaque volontaire. Le tableau 1 présente un aperçu de la procédure expérimentale.

le TABLEAU 1. Calendrier de la session expérimentale.
analyse statistique
Les caractéristiques cliniques et démographiques ont été analysées à l’aide de tests non paramétriques (sexe) et d’une analyse à un facteur de la variance (ANOVA; âge, IMC et trait STAI).,
les scores des deux facteurs du VAMS, la pression systolique et diastolique artérielle et la fréquence cardiaque ont été analysés avec une analyse à mesures répétées de la variance (ANOVA à mesures répétées) comprenant les facteurs « phase », « groupes » et interaction phase-groupe. Dans les cas où les conditions de sphéricité n’étaient pas atteintes, les degrés de liberté du facteur répété étaient corrigés avec L’epsilon de Huynh-Feldt. Des comparaisons entre les groupes ont été faites à chaque phase à l’aide d’une ANOVA à un facteur suivie de plusieurs comparaisons avec le test de Student-Newman-Keuls.,
l’analyse des données a été effectuée à l’aide du Package statistique pour les Sciences sociales (SPSS) version 17, et le niveau de signification adopté était p< 0.05.
Résultats
Les caractéristiques démographiques et cliniques des sujets sont présentés dans le Tableau 2. Les groupes ne différaient pas de manière significative en ce qui concerne le sexe, l’âge, L’IMC et les scores du trait STAI.

le TABLEAU 2. Démographiques et cliniques des caractéristiques des groupes.,
L’ANOVA de mesures répétées des scores dans le facteur d’anxiété des VAMS a montré un effet significatif de la phase (F3,162 = 60.24; p < 0.001), du groupe (F4,54 = 3.25; p = 0.018) et de l’interaction phase-groupe (F12, 162 = 3,79; p < 0,001,figure 1A). Les comparaisons Post hoc entre les groupes dans chaque phase ont montré des différences significatives (p< 0.05) entre PLAC et CLON aux phases de parole et de post-stress., Les scores du groupe CBD-300 étaient significativement différents de ceux du groupe CBD-900 à la phase de parole et de ceux des groupes PLAC et CBD-100 pendant la phase post-stress (p < 0.05). À titre d’illustration, la Figure 1B montre la courbe dose-réponse en U inversé induite par le CBD à la phase post-stress. En ce qui concerne le facteur de sédation des VAMS, les mesures répétées ANOVA ont montré des effets significatifs de la phase (F2.16,116.7 = 3.11; p = 0.028) et du groupe (F4,54 = 3.48; p = 0.013, Figure 2a)., Une comparaison générale post hoc entre les groupes a montré que le clonazépam induisait un effet sédatif plus élevé par rapport aux autres groupes (effet principal du traitement). Un effet similaire a été observé à la phase post-stress (p< 0,05).
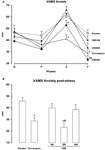
la FIGURE 1. Changements dans les scores du facteur d’anxiété de L’échelle D’Humeur analogique visuelle (VAMS) (mm) induits par la prise de parole en public chez des volontaires sains (A) pendant au début (B) et pendant les phases pré-stress (P), discours (s) et post-stress (F) (A)., Par souci de clarté, les résultats de la dernière phase (F) sont également présentés sous forme de graphique à barres (B). Les Points représentent les moyennes ± SEM de 11-12 sujets. Les astérisques ( ∗ ) indiquent des différences statistiquement significatives par rapport au groupe placebo, ( + ) indique une différence significative par rapport au groupe CBD-900 et (&) indique une différence significative par rapport au groupe CBD-100.
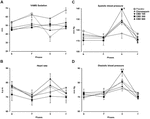
la FIGURE 2., Changements dans le facteur de sédation des VAMS (mm, A), de la fréquence cardiaque , de la pression artérielle systolique (C) et diastolique (D) (mm Hg) induits par la prise de parole en public chez des volontaires sains. Les Points représentent les moyennes ± SEM de 11-12 sujets. Les astérisques ( ∗ ) indiquent des différences statistiquement significatives par rapport aux autres groupes, (&) indique une différence significative par rapport au clonazépam, et ( $ ) indique une différence significative par rapport au groupe CBD-100.,
Discussion
Nous avons utilisé le TPSRS pour induire expérimentalement l’anxiété et avons étudié si l’effet anxiolytique du CBD chez l’homme produit une courbe dose-réponse en forme de U inversé. Dans la lignée des preuves antérieures (Zuardi et al., 2013), ce protocole a considérablement augmenté l’anxiété subjective, la pression artérielle et la fréquence cardiaque, comme le montre l’effet significatif de la phase trouvée dans une ANOVA à mesures répétées., De plus, le TPSRS a été sensible à la détection de l’effet anxiolytique du clonazépam, un médicament anxiolytique bien connu, suggérant qu’il peut être utilisé pour identifier des médicaments potentiellement anxiolytiques.
à la dose de 300 mg, Le CBD a significativement diminué l’anxiété subjective par rapport au groupe PLAC pendant la phase post-vocale du protocole. Cependant, la même chose n’était pas vraie pour une dose inférieure (100 mg) ou supérieure (900 mg) du médicament., De plus, les scores d’anxiété subjective du groupe CBD-300 différaient également significativement de ceux du groupe CBD-900 pendant la phase de parole et du groupe CBD-100 pendant la phase post-parole. Ces résultats suggèrent que l’effet anxiolytique aigu du CBD suivait une courbe dose-réponse en forme de U inversé, ce qui est cohérent avec les résultats d’études animales (Guimarães et al., 1990; Levin et coll., 2014; Nazario et coll., 2015; Peres et coll., 2016). Fait intéressant, la même dose de CBD qui a produit des effets anxiolytiques (300 mg) n’a pas réduit la systolique et la DBP que le clonazépam., Cette dissociation entre les effets anxiolytiques et sympathoinhibiteurs suite à l’administration aiguë de CBD est cohérente avec nos observations utilisant le SPST chez des volontaires sains (Zuardi et al., 1993) et chez les patients atteints de phobie sociale (Bergamaschi et coll., 2011a).
le mécanisme sous-jacent à ce modèle d’effet dose-réponse du CBD ne peut pas encore être entièrement expliqué. Chez l’homme, les zones cérébrales limbiques et paralimbiques semblent être impliquées dans l’action anxiolytique du CBD., Par exemple, des études utilisant la tomodensitométrie par émission de photons uniques (SPECT) chez des volontaires sains et des patients naïfs de médicaments atteints de SAD ont montré l’implication des mêmes zones impliquées dans l’effet anxiolytique du CBD 400 mg, à savoir le gyrus parahippocampique gauche et le complexe amygdale-hippocampe gauche (Crippa et al., 2004, 2011). En utilisant l’imagerie par résonance magnétique fonctionnelle (IRMf) chez des volontaires sains, les chercheurs ont découvert que le CBD 600 mg atténuait l’activation de l’amygdale et du cortex cingulaire antérieur lors de la reconnaissance d’expressions faciales craintives (Fusar-Poli et al., 2009)., Les auteurs ont en outre expliqué que cette action du CBD était médiée par des altérations de la connectivité préfrontale sous-corticale via l’amygdale et le cortex cingulaire antérieur (Fusar-Poli et al., 2010).
malgré l’identification de zones cérébrales pouvant être impliquées dans l’effet anxiolytique du CBD, le mécanisme pharmacologique spécifique responsable de cet effet reste à élucider., Le CBD est un médicament avec de multiples cibles pharmacologiques, y compris l’interaction avec plusieurs récepteurs (CB1, CB2, GPR55, TRPV1 et 5-HT1A), l’interférence avec l’absorption et le métabolisme des endocannabinoïdes et l’augmentation de la neurogenèse hippocampique dans le cerveau adulte (Zuardi et al., 2017). Plusieurs études ont soutenu l’implication des récepteurs 5-HT1A dans l’action anxiolytique aiguë du CBD., Par exemple, l’effet anxiolytique induit par les injections systémiques ou intra-dorsales de gris périaquéductal (DPAG) de CBD chez le rat est empêché par un antagoniste des récepteurs 5-HT1A (Campos et Guimarães, 2008; Soares et al., 2010). Une interaction similaire entre les récepteurs CBD et 5-HT1A dans d’autres structures cérébrales liées au contrôle des comportements anxieux, tels que le noyau de lit de la strie terminale ou le cortex frontal préliminaire, est également impliquée dans l’atténuation des réponses anxieux (Gomes et al., 2011, 2012; Fogaça et coll., 2014)., Dans les cellules cultivées, le CBD a été signalé comme agoniste des récepteurs 5-HT1A (Russo et al., 2005), bien que des études récentes suggèrent que ce n’est pas le cas dans les tranches ou les conditions in vivo. La facilitation de la neurotransmission médiée par le 5-HT1A par le CBD ne semble pas impliquer le blocage de la recapture du 5-HT ou des modifications de l’expression de l’ARNm 5-HT1A dans le DPAG après l’administration chronique du CBD (Campos et al., 2013). Ces observations suggèrent que la modulation des récepteurs 5-HT1A par le CBD est complexe et pourrait impliquer des interactions allostériques (Rock et al., 2011).,
comme mentionné précédemment, les mécanismes responsables de la courbe dose-réponse en forme de U inversé du CBD sont mal compris. Ils pourraient impliquer des interactions avec le récepteur vanilloïde 1 ou TRPV1. À des concentrations élevées, le CBD peut activer ces récepteurs et faciliter la libération de glutamate et les réponses défensives (Guimarães et al., 1991; Campos et Guimarães, 2009). Ce mécanisme pourrait masquer L’effet anxiolytique du CBD médié par les récepteurs 5-HT1A., Tester cette possibilité en utilisant des injections intra-DPAG chez le rat, Campos et Guimarães (2009) ont montré que le prétraitement avec un antagoniste du TRPV1 (capsazépine) transformait une dose plus élevée et inefficace de CBD en anxiolytique. Il reste à tester si un mécanisme similaire est également impliqué dans la courbe dose-réponse en forme de U observée dans notre étude. En accord avec les preuves antérieures indiquant que le CBD a des propriétés sédatives plus faibles par rapport aux benzodiazépines (Zuardi et al., 1993), la dose anxiolytique de CBD (300 mg) induit un niveau de sédation significativement plus faible que le clonazépam., C’est un avantage qui doit être souligné, car la sédation et la déficience de la coordination motrice sont parmi les effets indésirables les plus courants des benzodiazépines, en plus de la dépendance potentielle, des déficits cognitifs et des symptômes de sevrage, en particulier dans la vieillesse (Sgnaolin et al., 2016). Ces effets secondaires n’ont pas été observés avec L’utilisation de CBD (Bergamaschi et al., 2011b).
Les résultats présentés ici doivent être interprétés avec prudence, étant donné les limites de notre étude., Premièrement, il aurait été souhaitable de mesurer les niveaux plasmatiques de CBD et de clonazépam et de relier ces mesures à l’ampleur des niveaux d’anxiété; sans courbe dose-réponse, des doutes subsistent quant à savoir si les effets du CBD suivent réellement une courbe en U inversée. Il convient de noter, cependant, que les études précédentes n’ont pas été en mesure d’établir une relation directe entre les niveaux plasmatiques de CBD et ses effets cliniques (Agurell et al., 1986). En outre, la petite taille de l’échantillon limite la puissance statistique de l’essai., En outre, le plan de l’étude ne nous permet pas d’exclure la possibilité qu’une autre dose modérée (par exemple, 400 ou 600 mg) ait eu des effets anxiolytiques encore plus importants. Par exemple, des études antérieures ont montré des effets anxiolytiques aigus de 400 mg de CBD dans des études SPECT chez des volontaires sains (Crippa et al., 2004) et chez les patients atteints de phobie sociale (Crippa et coll., 2011) et de CBD 600 mg dans une expérience IRMf avec des hommes en bonne santé (Bhattacharyya et al., 2010)., Bien que cela ne soit pas nécessaire pour cette étude de preuve de concept, ces limites pourraient être surmontées dans de futures études examinant 2-3 autres doses entre 300 et 900 mg pour établir un véritable indice thérapeutique.
Conclusion
nos résultats concordent avec les preuves d’études précliniques et soutiennent l’idée que le CBD induit des effets anxiolytiques aigus avec une courbe dose-réponse en forme de U inversé chez l’homme. Ces résultats soulignent l’importance du choix prudent des plages de doses lors de l’étude des effets thérapeutiques potentiels du CBD., D’autres études évaluant la courbe dose-réponse du CBD dans d’autres conditions telles que la schizophrénie, la douleur, l’épilepsie et la maladie de Parkinson et impliquant l’administration chronique de CBD sont nécessaires pour traduire les preuves précliniques en pratique clinique et pour déterminer la fenêtre thérapeutique précise du CBD pour chaque condition.
contributions des auteurs
AZ, JH et JC ont conçu l’étude. NR, AS et SB ont mené les expériences. AZ et FG ont effectué l’analyse statistique. AZ a écrit la première ébauche du manuscrit., Tous les auteurs ont contribué au manuscrit final et l’ont approuvé.
déclaration de conflit d’intérêts
AZ, JH, FG et JC sont co-Inventeurs (Mechoulam R, JC, Guimaraes FS, AZ, JH, Breuer A) du brevet « Fluor CBD compounds, compositions and uses thereof. Pub. Aucun.: WO / 2014 / 108899. Demande Internationale No.: PCT/IL2014/050023”Def. NOUS n’. Reg. 62193296; 29/07/2015; INPI le 19/08/2015 (BR1120150164927). L’Université de São Paulo a concédé le brevet à Phytecs Pharm (résolution USP n ° 15.1.130002.1.1)., L’Université de São Paulo a conclu un accord avec Prati-Donaduzzi (Toledo, Brésil) pour « développer un produit pharmaceutique contenant du cannabidiol synthétique et prouver son innocuité et son efficacité thérapeutique dans le traitement de l’épilepsie, de la schizophrénie, de la maladie de Parkinson et des troubles anxieux. »JH et JC ont reçu le soutien de voyage de Bspg-Pharm.
les autres auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière pouvant être interprétée comme un conflit d’intérêts potentiel.,
Les examinateurs RWG, KA et handling Editor ont déclaré leur affiliation commune, et le handling Editor déclare que le processus répondait néanmoins aux normes d’un examen juste et objectif.
Remerciements
AZ, JH, FG et JC sont récipiendaires d’une bourse du Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq, Brésil). La présente étude a été soutenue par une subvention CNPq (CNPq/MS/SCTIE/DECIT N∘ 26/2014-Pesquisas sobre Distúrbios Neuropsiquiátricos; 466805/2014-4) et BSPG-Pharm (Sandwich, UK) a gentiment fourni du CBD sans frais.,
Campos, A. C., et Guimarães, F. S. (2008). Implication des récepteurs 5HT1A dans les effets anxiolytiques du cannabidiol injecté dans le gris périaquéductal dorsolatéral des rats. Psychopharmacologie (Berl) 199, 223-230. doi: 10.1007 / s00213-008-1168-il s’agit d’un outil de recherche et de recherche qui permet de créer des liens entre les utilisateurs et les utilisateurs. Preuve d’un rôle potentiel des récepteurs TRPV1 dans le gris périaquéductal dorsolatéral dans l’atténuation des effets anxiolytiques des cannabinoïdes. Prog., Neuropsychopharmacol. Biol. Psychiatry 33, 1517–1521. doi: 10.1016/j.pnpbp.2009.08.017
PubMed Abstract | CrossRef Full Text | Google Scholar