10.2 Brønsted-Lowry Définition des Acides et des Bases
Objectifs d’Apprentissage
- Reconnaître un composé Brønsted-Lowry acide ou d’une Brønsted-Lowry base.
- illustrer le processus de transfert de protons qui définit une réaction acide-base de Brønsted-Lowry.
L’ammoniac (NH3) augmente la concentration d’ions hydroxydes en solution aqueuse en réagissant avec l’eau plutôt que de libérer directement des ions hydroxydes., En fait, les définitions D’Arrhenius d’un acide et d’une base se concentrent sur les ions hydrogène et les ions hydroxyde. Existe-t-il des définitions plus fondamentales pour les acides et les bases?
en 1923, le scientifique danois Johannes Brønsted et le scientifique anglais Thomas Lowry proposèrent indépendamment de nouvelles définitions pour les acides et les bases. Plutôt que de considérer les ions hydrogène et hydroxyde, ils se sont concentrés uniquement sur l’ion hydrogène. Un composé acidA de Brønsted-Lowry qui fournit un ion hydrogène (H+) dans une réaction; un donneur de protons. est un composé qui fournit un ion hydrogène dans une réaction., Une base de Brønsted-Lowryun composé qui accepte un ion hydrogène (H+) dans une réaction; un accepteur de protons., inversement, est un composé qui accepte un ion hydrogène dans une réaction. Ainsi, les définitions Brønsted-Lowry d’un acide et d’une base se concentrent sur le mouvement des ions hydrogène dans une réaction, plutôt que sur la production d’ions hydrogène et d’ions hydroxyde dans une solution aqueuse.
utilisons la réaction de l’ammoniac dans l’eau pour démontrer les définitions Brønsted-Lowry d’un acide et d’une base., L’ammoniac et les molécules d’eau sont des réactifs, tandis que l’ion ammonium et l’ion hydroxyde sont des produits:
NH3(aq) + H2O(ℓ) → NH4+(aq) + OH−(aq)
Ce qui s’est passé dans cette réaction, c’est que la molécule d’eau d’origine a donné un ion hydrogène à la molécule Nous pouvons illustrer ceci comme suit:
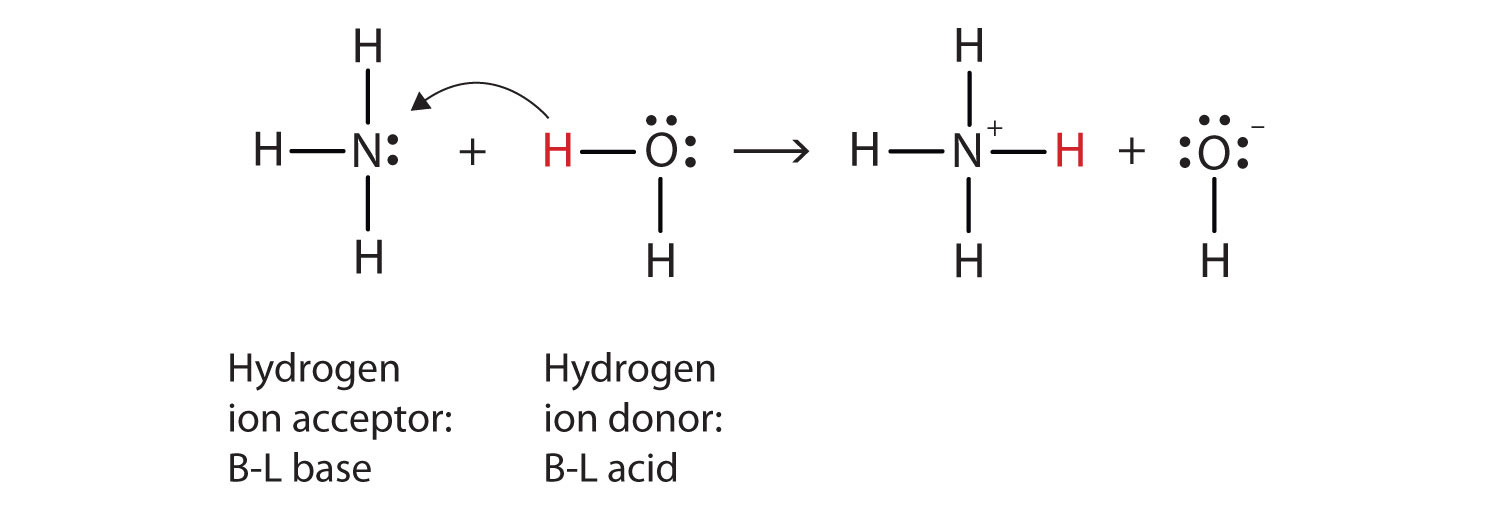
parce que la molécule d’eau donne un ion hydrogène à l’ammoniac, c’est L’acide Brønsted-Lowry, tandis que la molécule d’ammoniac—qui accepte l’ion hydrogène—est la base Brønsted-Lowry., Ainsi, l’ammoniac agit comme base à la fois dans le sens D’Arrhenius et dans le sens de Brønsted-Lowry.
un acide D’Arrhenius comme l’acide chlorhydrique est-il encore un acide au sens de Brønsted-Lowry? Oui, mais cela nous oblige à comprendre ce qui se passe réellement lorsque le HCl est dissous dans l’eau. Rappelons que l’atome d’hydrogène est un seul proton entouré d’un seul électron. Pour fabriquer l’ion hydrogène, nous enlevons l’électron, laissant un proton nu. Avons-nous vraiment des protons nus flottant dans une solution aqueuse? Non, nous n’avons pas., Ce qui se passe vraiment, c’est que L’ion H+ s’attache à H2O pour faire H3O+, qui est appelé l’ion hydronium. Dans la plupart des cas, H+ et H3O+ représentent la même espèce, mais écrire H3O+ au lieu de H+ montre que nous comprenons qu’il n’y a pas de protons nus flottant en solution. Au contraire, ces protons sont en fait attachés à des molécules de solvant.
Remarque
un proton en solution aqueuse peut être entouré de plus d’une molécule d’eau, ce qui conduit à des formules comme H5O2+ ou H9O4+ plutôt que H3O+. Il est cependant plus simple d’utiliser H3O+.,
dans cet esprit, comment définissons-nous le HCl comme un acide au sens de Brønsted-Lowry? Considérez ce qui se passe lorsque HCl est dissous dans H2O:
HCl + H2O(ℓ) → H3O+(aq) + Cl−(aq)
nous pouvons décrire ce processus en utilisant des diagrammes de points électroniques de Lewis:
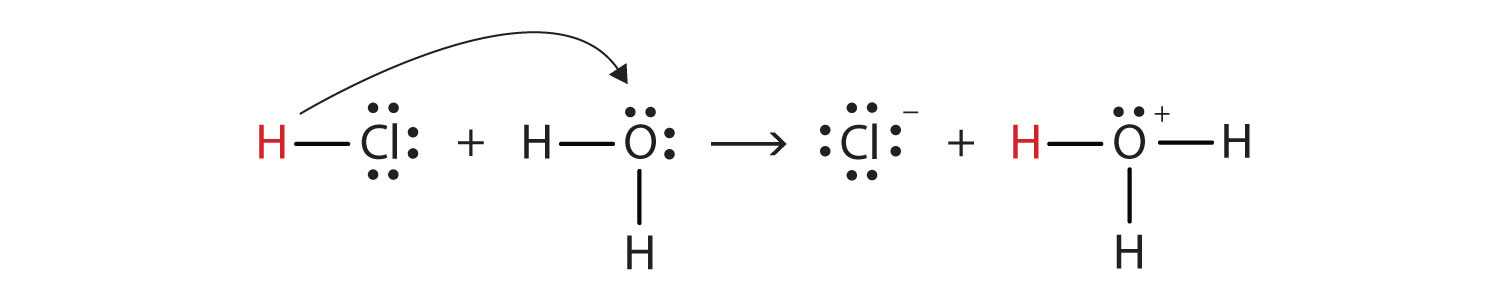
maintenant, nous voyons qu’un ion hydrogène est transféré de la molécule HCl à la molécule H2O pour produire des ions chlorure et des ions hydronium. En tant que donneur d’ions hydrogène, HCl agit comme un acide Brønsted-Lowry; en tant qu’accepteur d’ions hydrogène, H2O est une base Brønsted-Lowry., Le HCl est donc un acide non seulement au sens D’Arrhenius, mais aussi au sens de Brønsted-Lowry. De plus, selon les définitions de Brønsted-Lowry, H2O est une base dans la formation de HCl aqueux. Ainsi, les définitions Brønsted-Lowry d’un acide et d’une base classent la dissolution du HCl dans l’eau comme une réaction entre un acide et une base—bien que la définition D’Arrhenius n’aurait pas marqué H2O une base dans cette circonstance.
Remarque
tous les acides et bases D’Arrhenius sont également des acides et bases de Brønsted-Lowry. Mais tous les acides et bases de Brønsted-Lowry ne sont pas des acides et des bases D’Arrhenius.,
Exemple 3
l’Aniline (C6H5NH2) est légèrement soluble dans l’eau. Il a un atome d’azote qui peut accepter un ion hydrogène à partir d’une molécule d’eau tout comme l’atome d’azote en ammoniac n’. Écrivez l’équation chimique de cette réaction et identifiez l’acide et la base de Brønsted-Lowry.
la Solution
C6H5NH2 et H2O sont les réactifs. Lorsque C6H5NH2 accepte un proton de H2O, il gagne un h supplémentaire et une charge positive et laisse un ion OH derrière lui., La réaction est la suivante:
C6H5NH2(aq) + H2O(ℓ) → c6h5nh3+(aq) + OH−(aq)
comme C6H5NH2 accepte un proton, c’est la base de Brønsted-Lowry. La molécule H2O, parce qu’elle donne un proton, est l’acide Brønsted-Lowry.
exercice de renforcement des compétences
-
La caféine (C8H10N4O2) est un stimulant présent dans les cafés et les thés. Dissous dans l’eau, il peut accepter un proton d’une molécule d’eau. Écrivez l’équation chimique de ce processus et identifiez L’acide et la base de Brønsted-Lowry.,
Les définitions Brønsted-Lowry d’un acide et d’une base peuvent être appliquées aux réactions chimiques qui se produisent dans des solvants autres que l’eau. L’exemple suivant illustre.
exemple 4
l’amide de Sodium (NaNH2) se dissout dans le méthanol (CH3OH) et se sépare en ions sodium et en ions amides (NH2−). Les ions amides réagissent avec le méthanol pour produire de l’ammoniac et l’ion méthoxyde (CH3O−). Écrivez une équation chimique équilibrée pour ce processus et identifiez L’acide et la base de Brønsted-Lowry.,
Solution
l’équation pour la réaction est entre NH2− et CH3OH pour faire NH3 et CH3O− est la suivante:
NH2−(solv) + CH3OH(ℓ) → NH3(solv) + CH3O−(solv)
l’étiquette (solv) indique que les espèces sont dissoutes dans un solvant, contrairement à (aq), qui spécifie une solution aqueuse (H2O). Dans cette réaction, nous voyons que l’ion NH2 accepte un proton d’une molécule de CH3OH pour faire une molécule de NH3. Ainsi, en tant qu’accepteur de protons, NH2− est la base de Brønsted-Lowry. En tant que donneur de protons, le CH3OH est l’acide de Brønsted-Lowry.,
exercice de renforcement des compétences
-
Le chlorure de Pyridinium (C5H5NHCl) se dissout dans l’éthanol (C2H5OH) et se sépare en ions pyridinium (C5H5NH+) et en ions chlorure. L’ion pyridinium peut transférer un ion hydrogène à une molécule de solvant. Écrivez une équation chimique équilibrée pour ce processus et identifiez L’acide et la base de Brønsted-Lowry.
Pour Votre Santé: Brønsted-Lowry Réactions Acide-Base dans les produits Pharmaceutiques
Il existe de nombreuses applications intéressantes de Brønsted-Lowry réactions acide-base dans l’industrie pharmaceutique., Par exemple, les médicaments doivent souvent être solubles dans l’eau pour une efficacité maximale. Cependant, de nombreux composés organiques complexes ne sont pas solubles ou ne sont que légèrement solubles dans l’eau. Heureusement, les médicaments qui contiennent des atomes d’azote acceptant les protons (et il y en a beaucoup) peuvent réagir avec de l’acide chlorhydrique dilué . Les atomes d’azote-agissant comme bases de Brønsted-Lowry-acceptent les ions hydrogène de l’acide pour produire un ion, qui est généralement beaucoup plus soluble dans l’eau., Les molécules médicamenteuses modifiées peuvent ensuite être isolées sous forme de sels de chlorure:
RN(sl aq) + H+(aq) → RNH+(aq) →Cl−(aq) RNHCl(s)
où RN représente un composé organique contenant de l’azote. L’étiquette (sl aq) signifie « légèrement aqueux”, indiquant que le composé RN n’est que légèrement soluble. Les médicaments qui sont modifiés de cette manière sont appelés sels de chlorhydrate. Les exemples incluent le puissant analgésique codéine, qui est couramment administré sous forme de chlorhydrate de codéine. Les acides autres que l’acide chlorhydrique sont également utilisés. L’acide bromhydrique, par exemple, donne des sels d’hydrobromure., Le dextrométhorphane, un ingrédient de nombreux médicaments contre la toux, est distribué sous forme d’hydrobromure de dextrométhorphane. La figure d’accompagnement montre un autre médicament sous forme de sel de chlorhydrate.
Le nom de ce médicament il est clair qu’il existe sous forme de chlorhydrate.
© Thinkstock
le Concept de l’Exercice de Révision
-
Donnez les définitions de Brønsted-Lowry acide et d’une Brønsted-Lowry base.,
Réponse
-
un Brønsted-Lowry acide est un donneur de proton, tandis qu’un Brønsted-Lowry base est un accepteur de proton.
principaux points à retenir
- Un acide Brønsted-Lowry est un donneur de protons, et une base Brønsted-Lowry est un accepteur de protons.
- Les Réactions acide-base de Brønsted-Lowry sont essentiellement des réactions de transfert de protons.
Exercices
-
l’Étiquette de chaque réactif comme un Brønsted-Lowry acide ou d’une Brønsted-Lowry base.,
HCl (aq) + NH3(AQ) → NH4 + (AQ) + Cl−(AQ)
-
étiqueter chaque réactif comme un acide Brønsted-Lowry ou une base Brønsted-Lowry.
H2O(ℓ)+N2H4(AQ) → N2H5 + (aq) + OH−(AQ)
-
expliquez pourquoi un acide de Brønsted-Lowry peut être appelé donneur de protons.
-
expliquer pourquoi une base de Brønsted-Lowry peut être appelée accepteur de protons.
-
Ecrire l’équation chimique de la réaction de l’ammoniac dans l’eau et l’étiquette de la Brønsted-Lowry acide et de la base.,
-
écrivez l’équation chimique de la réaction de la méthylamine (CH3NH2) dans l’eau et marquez L’acide et la base de Brønsted-Lowry.
-
démontrer que la dissolution de HNO3 dans l’eau est en fait une réaction acide-base de Brønsted-Lowry en la décrivant avec une équation chimique et en marquant L’acide et la base de Brønsted-Lowry.,
-
identifiez L’acide et la base Brønsted-Lowry dans l’équation chimique suivante:
C3H7NH2(aq) + H3O+(aq) → C3H7NH3+(aq) + H2O(ℓ)
-
écrivez l’équation chimique de la réaction qui se produit lorsque le chlorhydrate de cocaïne (c17h22clno4) se dissout dans L’eau et donne un proton à une molécule D’eau. (Lorsque les chlorhydrates se dissolvent dans l’eau, ils se séparent en ions chlorure et en cations appropriés.)
-
Si l’hydrobromure de codéine a la formule C18H22BrNO3, Quelle est la formule du composé parent codéine?,